Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного лития Li++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
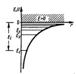
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1) 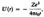 где r — расстояние между электроном и ядром. Графически функция U(r) изображена жирной кривой на рис. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
где r — расстояние между электроном и ядром. Графически функция U(r) изображена жирной кривой на рис. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
 Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение
Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение
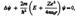 где т — масса электрона, Е — полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
где т — масса электрона, Е — полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
|
|
|
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для  следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина Q(R)— это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A(R) определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь. Обменный интеграл для молеклы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются». 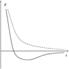
Насыщение ковалентной связи. Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
|
|
|
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Радиус атома водорода 0.53 10-8 см
Масса атома водорода 1.67 10-27 кг
 2018-01-08
2018-01-08 1032
1032








