Средняя длина свободного пробега < λ >-расстояние, которое пробегает молекула между двумя очередными столкновениями. Зависит от эффективного сечения –то наименьшее расстояние, на которое сближаются молекулы в момент удара
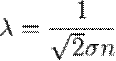
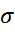 — эффективное сечение молекулы, n — концентрация молекул.
— эффективное сечение молекулы, n — концентрация молекул. 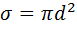 (
(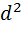 –эффективный диаметр)
–эффективный диаметр)
За одну секунду молекула проходит путь, равный средней арифметической скорости 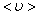 . За ту же секунду молекула претерпевает z столкновений. Следовательно, <z>=
. За ту же секунду молекула претерпевает z столкновений. Следовательно, <z>= 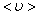 /<λ>
/<λ> 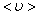 - скорость
- скорость
Билет N9
№1.Закон сохранения механической энергии. Абсолютно упругий и неупругий удар
Если тела, составляющие замкнутую механическую систему, взаимодействуют между собой только посредством сил тяготения и упругости, то работа этих сил равна изменению потенциальной энергии тел, взятому с противоположным знаком: 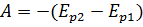
По теореме о кинетической энергии эта работа равна изменению кинетической энергии тел: 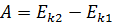
Следовательно 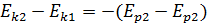 или
или
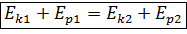
Сумма кинетической и потенциальной энергий тел, составляющих замкнутую систему и взаимодействующих между собой посредством сил тяготения и сил упругости, остается низменной.
|
|
|
Это утверждение выражает закон сохранения механической энергии. Он является следствием законов Ньютона. Сумму 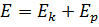 называют полной механической энергией.
называют полной механической энергией.
Ударом(или столкновением) принято называть кратковременное взаимодействие тел, в результате которого их скорости испытывают значительные изменения.
Абсолютно неупругим ударом называют такое ударное взаимодействие, при котором тела соединяются друг с другом и движутся дальше как одно тело. Механическая энергия не сохраняется, она частично или полностью переходит во внутреннюю энергию тел. Пример: попадание пули в баллистический маятник.
Абсолютно упругим ударом называют столкновение, при котором сохранятся механическая энергия системы тел. Пример: центральный удар двух бильярдных шаров.
№2. Реальный газ. Уравнение Ван-дер-Ваальса
Реальный газ - газ, который не описывается уравнением состояния идеального газа Клапейрона – Менделеева. Молекулы в реальном газе взаимодействуют между собой и занимают определенный объем. Наиболее корректно описывает свойства реальных газов уравнение: 
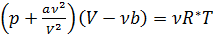 -уравнение Ван-дер-Ваальса;
-уравнение Ван-дер-Ваальса;
a и b-постоянные Ван-дер-Ваальса; R*-индивидуальная газовая постоянная
Внутренняя энергия реального газа зависит не только от температуры, но и от объема газа. Это связанно с тем, что силы Ван-дер-Ваальса стремятся притянуть молекулы газа, т.е. уменьшить его объем, и тем самым уменьшить энергию системы.
Билет N10
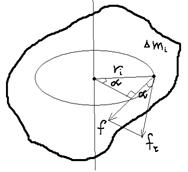
1) Рассмотрим вращение тв. тела под действием силы F:
|
|
|
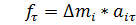
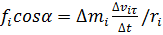
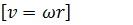
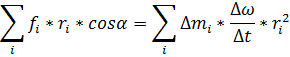
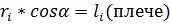

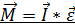
2) Термодинамика-раздел физики, в котором изучаются явления с энергетической точки зрения.Теплота-микроскопический способ передачи эн-ии.
1-ое начало термодинамики: тепло, полученное системой, идет на изменение его внутренней энергии
Тепло идет на изменение внутренней энергии системы и на совершение работы над телами

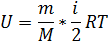
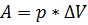
Невозможно построить вечный двигатель первого рода.(двигатель, который совершал бы работу большую, чем кол-во затраченного тепла)
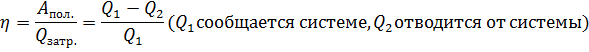
Теплоемкость системы-кол. теплоты, кот. нужно сообщить телу либо системе, чтобы его t изм. на 1 С.
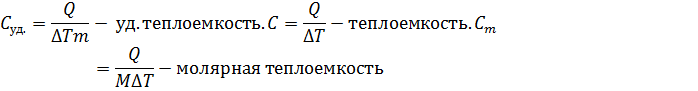
Билет N11
1. Кинетическая энергия тела, движущегося произвольным образом, равна сумме кинетических энергий всех n материальных точек па которые это тело можно разбить:
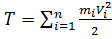 .
.
Если тело вращается вокруг неподвижной оси с угловой скоростью w, то линейная скорость i-ой точки равна
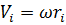 , где
, где 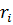 , - расстояние от этой точки до оси вращения.
, - расстояние от этой точки до оси вращения.
Следовательно: 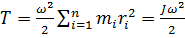 , где J- момент инерции тела относительно оси вращения. В общем случае движение твердого тела можно представить в виде суммы двух движений - поступательного со скоростью, равной скорости
, где J- момент инерции тела относительно оси вращения. В общем случае движение твердого тела можно представить в виде суммы двух движений - поступательного со скоростью, равной скорости 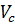 центра инерции тела, и вращения с угловой скоростью ω вокруг мгновенной оси, проходящей через центр инерции. При этом выражение для кинетической энергии тела преобразуется к виду
центра инерции тела, и вращения с угловой скоростью ω вокруг мгновенной оси, проходящей через центр инерции. При этом выражение для кинетической энергии тела преобразуется к виду
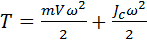 , где
, где 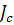 - момент инерции тела относительно мгновенной оси вращения, проходящей через центр инерции.
- момент инерции тела относительно мгновенной оси вращения, проходящей через центр инерции.
За время dt вращающееся тело совершит работу dA, равную произведению момента силы M на угол поворота 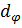 , сделанный радиусом этого тела, то есть dA=M
, сделанный радиусом этого тела, то есть dA=M 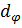 . Работу, совершенную вращающимся телом за единицу времени, называют мощностью вращающегося тела N, то есть
. Работу, совершенную вращающимся телом за единицу времени, называют мощностью вращающегося тела N, то есть 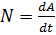 ,
, 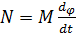 , где
, где 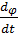 – мгновенное значение угловой скорости ω. Поэтому N=Mω.
– мгновенное значение угловой скорости ω. Поэтому N=Mω.
2.. Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы. Так как передачи теплоты при адиабатическом процессе не происходит, то уравнение I начала термодинамики принимает вид:
 ,
,
где ∆U-изменение внутренней энергии тела, A-работа, совершаемая системой. Внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0). Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит:
 Здесь T-температура системы, δQ-теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла.Работа газа при адиабатическом процессе равна:
Здесь T-температура системы, δQ-теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла.Работа газа при адиабатическом процессе равна:  ,где p-давление газа, dV-малое приращение объема. Основное уравнение термодинамики примет вид: dU=-pdV. Уравнение Пуассона для идеального газа:
,где p-давление газа, dV-малое приращение объема. Основное уравнение термодинамики примет вид: dU=-pdV. Уравнение Пуассона для идеального газа:  ,где V-объем газа,
,где V-объем газа,  -показатель адиабаты,
-показатель адиабаты,  и
и  -теплоёмкости газа соответственно при постоянном давлении и постоянном объёме. С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду:
-теплоёмкости газа соответственно при постоянном давлении и постоянном объёме. С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду:  ,где T-абсолютная температура газа. Или к виду:
,где T-абсолютная температура газа. Или к виду:  . Поскольку k всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент k. При адиабатическом процессе показатель адиабаты равен
. Поскольку k всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент k. При адиабатическом процессе показатель адиабаты равен 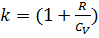 . 3.Задача:В закрытом сосуде находится 20г азота и 32г кислорода. Найти изменение внутренней энергии этой смеси при охлаждении её на 280.
. 3.Задача:В закрытом сосуде находится 20г азота и 32г кислорода. Найти изменение внутренней энергии этой смеси при охлаждении её на 280.
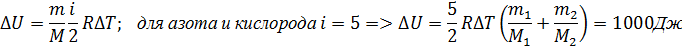
|
|
|
Билет N12
1) Дифференциальное уравнение гармонических колебаний и его решение. Энергия гармонического осциллятора.
Дифференциальное уравнение гармонических колебаний
(Любое нетривиальное решение этого дифференциального уравнения — есть гармоническое колебание с циклической частотой (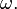 )
)
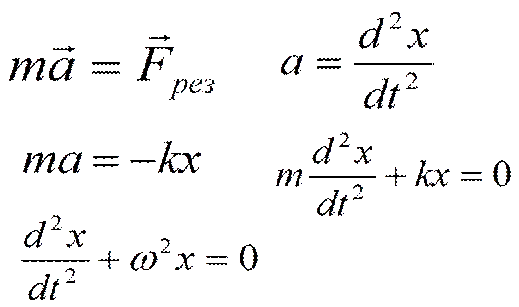
Энергия гармонического осциллятора
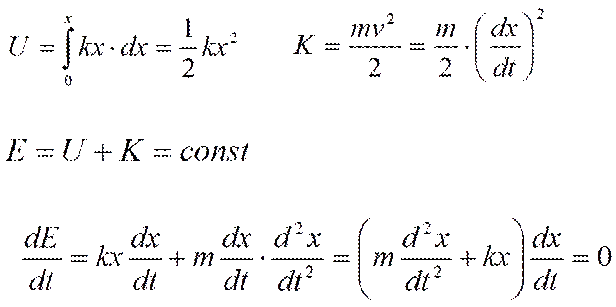
2) Применение первого начала термодинамики к изохорическому, изобарному, и изотермическому процессам.
Среди равновесных процессов, которые происходят с термодинамическими системами, отдельно рассматриваются изопроцессы, при которых один из основных параметров состояния остается постоянным.
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 1), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
 Q=dU
Q=dU
т.к. CV=dUm/dt,
 Q=dU
Q=dU
Тогда для произвольной массы газа получим
(1) 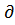 Q=dU=
Q=dU= 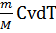
Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
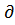 Q=dU=
Q=dU= 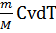 (2)
(2)
и равна площади заштрихованного прямоугольника (рис. 2). Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то
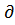 Q=dU=
Q=dU= 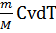 и pV2=
и pV2= 
откуда
V(2)-V(1)= 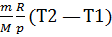
Тогда выражение (2) для работы изобарного расширения примет вид
A= 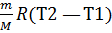 (3)
(3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой m количества теплоты
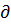 Q=
Q= 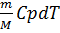
его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)
dU= 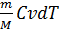
При этом газ совершит работу, определяемую выражением (3).
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
|
|
|
dU= 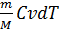
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из формул для работы газа и уравнения Менделеева-Клайперона найдем работу изотермического расширения газа:

Так как при Т=const внутренняя энергия идеального газа не изменяется:
dU= 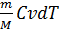 =0
=0
то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса
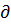 Q=
Q= 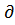 A
A
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
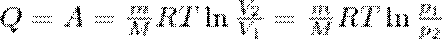 (4)
(4)
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
Билет №13
 2018-01-08
2018-01-08 1368
1368








