Диффу́зия- процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией.
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной)
первый закон Фика: 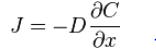
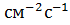
показывает, что плотность потока вещества J (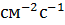 ) пропорциональна коэффициенту диффузии D (
) пропорциональна коэффициенту диффузии D (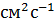 ) и градиенту концентрации
) и градиенту концентрации
второй закон Фика: 
Коэффициент диффузии D зависит от температуры
Билет N18
1. Стоячая волна — колебания в распределённых колебательных системах с характерным расположением чередующихся максимумов (пучностей) и минимумов (узлов) амплитуды. Практически такая волна возникает при отражениях от преград и неоднородностей в результате наложения отражённой волны на падающую. При этом крайне важное значение имеет частота, фаза и коэффициент затухания волны в месте отражения.
Примерами стоячей волны могут служить колебания струны, колебания воздуха в органной трубе; в природе — волны Шумана.
В одномерном случае две волны одинаковой частоты, длины волны и амплитуды, распространяющиеся в противоположных направлениях (например, навстречу друг другу), будут взаимодействовать, в результате чего может возникнуть стоячая волна. Например, гармоничная волна, распространяясь вправо, достигая конца струны, производит стоячую волну. Волна, что отражается от конца, должна иметь такую же амплитуду и частоту, как и падающая волна.
Рассмотрим падающую и отраженную волны в виде:
y1=y0sin(kx-wt) y2=y0*sin(kx+wt)
где y0 –амплитуда волн, w -циклическая (угловая) частота, измеряемая в радианах в секунду,
k -волновой вектор, измеряется в радианах на метр, и рассчитывается как 2π поделённое на длину волны,
Поэтому результирующее уравнение для стоячей волны y будет в виде суммы y1 и y2:
y=2y0cos(wt)sin(kx)
В случае гармонических колебаний в одномерной среде стоячая волна описывается формулой:
u=u0cos(kx)cos(wt-ϕ)
где u — возмущения в точке х в момент времени t, u0 — амплитуда стоячей волны, w— частота, k — волновой вектор, — ϕ фаза.
2. Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
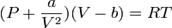 Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T < Tкр и монотонные T > Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 – это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD (жидкость) через двухфазное состояние (газ – жидкость) GL вдоль горизонтальной изотермы GCL.
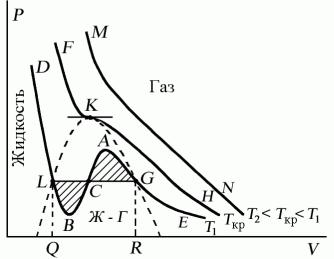 При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна
Билет N19
1. Эффе́кт До́плера — изменение частоты и длины волн, регистрируемых приёмником, вызванное движением их источника и/или движением приёмника.Эффект Доплера применим не только для звука но и для световых волн.
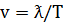 ; где ν-воспринимаемая приемником; ν0-частота звука
; где ν-воспринимаемая приемником; ν0-частота звука
1) 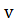 (ист)=0
(ист)=0
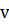 (приемника)=0
(приемника)=0 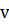 =ƛ/ ν* ν0
=ƛ/ ν* ν0
2) 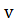 (приемника)>0
(приемника)>0
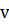 (ист)=0
(ист)=0
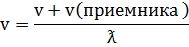
3) 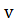 (ист)=0
(ист)=0
v= 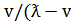 (ист)*T)
(ист)*T)
4) 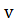 (приемника)>0
(приемника)>0
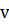 (ист)>0
(ист)>0
v= 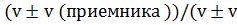 (ист))
(ист))
2. Внутренняя энергия реального газа будем определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп:
U=Eк+Eп.
Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие последних приводит к возникновению внутреннего давления p' на газ.Внутреняя энергия равна const.Следовательно -Eк= Eп - изменяя потенциальную энергию мы изменяем кинетическую, а следовательно и температуру.
Эффект Джоуля-Томсона:
Работа молекул газа против сил трения, в результате просачивания через перегородку, тратиться на изменение температуры газа. Охлаждение газа при расширении это положительный эффект Дж-Тм. Нагревание это отрицательный эффект.
Знак эффекта Дж-Тм зависит от того, какая из поправок играет большую роль в уравнении Вандервальса. Для одного и того же газа в зависимости от T и P может играть большую роль поправка А или В.Существуют такие параметры при которых роль поправок одинакова или такое состояние называется точки инверсии.
Билет N20
 2018-01-08
2018-01-08 11608
11608








