Во всех случаях при образовании молекулы из атомов электроны атомов изменяют состояние своего движения; это изменение особенно значительно у электронов валентных оболочек. Можно составить себе только приближенное представление, как движутся электроны в молекуле — даже для сравнительно простых систем квантовомеханические расчеты крайне сложны и часто практически невыполнимы. Однако несомненно, что распределение плотности электрических зарядов (выражают, указывая плотность электронного заряда) в общем случае неравномерно: одни атомы имеют избыточную электронную плотность, другие — пониженную. В методе ВС указывают различные крайние случаи распределения связывающих электронов.
Метод молекулярных орбиталей (МО) приводит в общем к тем же результатам, что и метод ВС, но имеет значительные преимущества. Основная идея метода МО заключается в том, чтобы рассматривать движение электрона в молекуле подобно тому, как это делается по отношению к электронам в атоме. Поэтому вводятся молекулярные орбитали (т. е. волновые функции электронов в молекуле), квантовые числа, характеризующие состояние электронов в молекуле, и т. д.
|
|
|
В методе МО предполагается, что данный электрон в молекуле движется па многоцентровой орбитали, т. е. в поле нескольких ядер. Строят для этого одного электрона все возможные молекулярные орбитали, а затем заполняют их электронами. Энергия электронов на связывающих орбиталях ниже, чем энергия электронов на исходных атомных орбиталях, а энергия на разрыхляющих — выше. В простейших случаях (при слабом перекрытии) разность между исходным уровнем и связывающей орбиталью равна разности между исходным уровнем и разрыхляющей орбиталью. Электроны прежде всего занимают связывающие орбитали. Появление электронов на разрыхляющих орбиталях означает возникновение сил отталкивания. При выполнении указанного равенства разностей в уровнях энергии притяжение, обусловленное парой электронов на связывающей орбитали, полностью компенсируется отталкиванием, вызванным наличием пары электронов на разрыхляющей орбитали.
По этой причине взаимодействие тех орбиталей атомов, на которых уже находятся по два электрона, не приводит к связыванию. Если, например, атом гелия, имеющий два электрона на первой оболочке, взаимодействует с другим атомом гелия, то, хотя и возникают две молекулярные орбитали — связывающая и разрыхляющая, на каждой из них окажется по два электрона и в итоге притяжение будет полностью скомпенсировано отталкиванием — молекула Н2 образоваться не сможет.
Следовательно, фактически при взаимодействии атомов все электроны, а не только валентные, изменяют свое состояние, но валентные силы возникают в результате перехода части электронов на пониженные энергетические уровни — связывающие орбитали, нескомпенсированные разрыхляющими орбиталями; последние должны оставаться или полностью, или частично пустыми. Применение метода МО начинается с того, что отыскивают систему молекулярных уровней, получившихся из атомов путем расщепления. Следующий шаг заключается в размещении электронов по уровням.
|
|
|
Несмотря на разработку мощных приближенных квантовомеханических методов (В. А. Фок, Слейтер) и применение электронных вычислительных машин, вычисление волновых функций молекул остается очень трудной операцией, требующей длительного времени и ряда точных экспериментальных данных. Наглядное представление о распределении электронного облака в методе МО достигается с помощью схематических рисунков, изображающих условно (точками или контуром) границы областей, в которых плотность заряда велика. В случаях, когда речь идет о несложных молекулах, такие схемы хорошо изображают важнейшую особенность химического связывания — перекрывание электронных облаков.
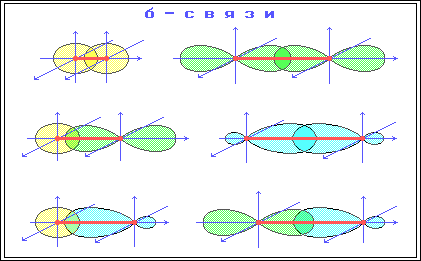
В зависимости от характера перекрытия электронных облаков получаются химические связи различных типов. Если перекрытие происходит по линии, соединяющей центры атома, то возникает сигма-связь, обозначаемая греческой буквой σ. В образовании этой связи могут принимать участие как s-, так и р-электроны. Если же перекрываются облака р-электронов, оси которых перпендикулярны к линии центров в молекуле, то получаются две разделенные друг от друга области; возникает пи-связь. Пи-связи обычно несколько слабее сигма-связей, но зато они могут объединять большое число атомов в общую электронную систему.
Метод валентных связей основан на квантово механической модели атома. И если вы разобрались с электронными формулами, с характеристикой электронного состояния атома в рамках квантово механической модели атома, то сейчас вам придется только остается подвести итоги всего предыдущего рассмотрения, потому что в рамках ВС нужно дать характеристику геометрии молекулы, основываясь на следующих процедурах. Во-первых, составить электронные формулы атомов, которые вступают во взаимодействие и образуют данную молекулу. Во-вторых, из всех электронов которые вы представили в этих формулах, нужно выбрать только валентные, потому что в процессе взаимодействия именно они и реагируют друг с другом. Третье действие в решении этой задачи, нужно распределить эти валентные электроны по квантовым ячейкам, то есть вы видите что все что говорилось в предыдущей теме. Дальше, из всех электронов которые вы распределили по квантовым ячейкам нужно выбрать только не спаренные т.е. так как мы определяли с вами спин валентность, только одиночные не спаренные электроны. Затем посмотреть на каких же подуровнях они находятся S или P мы ограничимся только этими двумя видами орбиталей, в противном случае будет очень сложно изобразить это наглядно, и нарисовать перекрывания этих орбиталей, вот вся работа, которая предусматривается методом валентных связей. Дело в том, что метод валентных связей, если говорить о его содержании эта та же самая теория Льюиса, но только изложена на другом более современном квантово-механическом языке. Там мы с вами говорили о том, что два атома обобщают свои валентные электроны. Можно также сказать на языке квантовой механике так: два атома взаимодействуют таким образом, что в пространстве образуется некая область, где с одинаковой вероятностью можно зафиксировать электрон одного атома и электрон второго с одинаковой вероятностью. Это и говорит о том, что орбитали которые собственно эту вероятность нам и представляют этой наглядной формы перекрываются, то есть некая общая область которая относится и к одному атому и к другому значит нужно нарисовать перекрывание орбитали. Задачка сугубо геометрическая, но нужно нарисовать это перекрывание так, чтобы получить максимально симметричную картинку. Кроме минимума энергии мером управляет еще и максимум симметрии, поэтому наша бедующая картина должна быть максимально симметрична. Сначала нужно посмотреть, а какие возможные варианты если говорить об S и P орбиталях. Возможные варианты двух видов, первая называется сигма перекрывания орбитали, чисто геометрически это такое перекрывание, которое происходит вдоль линии соединяющие ядра. Две орбитали S перекрываются только так, потому что вряд ли кто то может предложить что то иное двух сфер которые должны перекрываться. Две орбитали одна S другая P перекрываются только так, потому что тоже не возможно придумать ничего другого, а вот две орбитали P типа могут перекрываться так безусловно, но только в том случае если они лежат по одной прямой. 4 мин схема вот тогда между ними и происходит сигма перекрывания вдоль линии соединяющие ядра. Если же P орбитали в силу специфики атомов которые образуют данную молекулу, вынуждены быть направлены по параллельным осям, вот тогда между ними происходит абсолютно другой тип перекрывания он называется пи перекрывания.Pi перекрывания это значит боковое перекрывание орбитали с образованием двух областей, над плоскостью в которых лежат ядра, и под плоскостью в которых лежат ядра, двое кратное перекрывание, боковое перекрывание, Итак геометрически возможны только эти два варианта. Посмотрим, на каких то самых простых примерах. Ну может даже с молекулой водорода давайте и начнем. Итак, один атом водорода имеет один электрон находящийся на первом уровне S подуровня и второй атом водорода имеет точно такой же электрон. В квантовых ячейках естественно один электрон занимает одну квантовую ячейку и он же не спаренный одиночный. Значит, для того чтобы изобразить молекулу водорода в рамках метода ВС мы должны нарисовать сферическую орбиталь одного, сферическую орбиталь другого и их перекрывания с образованием общей области, которая соответствует факту завязывания химической связи. Картинка будет вот такая картинку вставить
|
|
|
|
|
|
Если мы возьмем два атома хлора, и построим из нее молекулу Cl2 то мне предстоит сначала работа по электронным формулам, потому что у хлора 17 мы с вами уже писали эту электронную формулу, поэтому можем это сделать гораздо быстрее. Валентные электроны 3S2 3P5 а всего их 7, что соответствует номеру группы, также легко разыскать потому что мы с вами обсуждали этот момент валентными называют только электроны последнего уровня, а в атоме хлора это третий и распределение по ячейкам показывает, что из всех этих семи электронов, только один реакционно способный потому что именно он один является не спаренным, то есть электронном, являющийся причиной одновалентного состояния атома хлора. Значит P орбиталь одного атома и P орбиталь второго должны перекрываться. Сигма связь более выгодна с точки зрения энергии, поэтому когда мы имеем две Pорбитали никак не связанные, то первый момент это сначала сигма связь образуется в данном случае вот она и образовалась и получилась такая схема для перекрывания орбитали в этой молекуле. Точно также можно построить схему перекрывания орбитали для молекулы хлора водорода уже используя информацию первого примера и второго и более сложные молекулы аммиака, серо водорода, воды и т.д. То есть решить задачу по характеристике молекулы методом ВС это значит изобразить схему перекрывания орбитали, а чтобы к ней прейти нужно проделать определенную работу которую мы с вами уже проделали и пункт этого плана перечислили. Так можно решать проблему с многими молекулами и отвечая на вопрос о геометрии, но не со всеми. Ну например, соединения бериллия, если вы начнете решать эту задачку для гидрида бериллия предположим форма которогоBeH2, то довольно скоро мы с вами зайдем в тупик, ну прежде всего у бериллия конфигурация 2S2 и не спаренных электронов нет. Правда и этот момент обсуждался, если вы помните, кроме основного состояния для многих атомов бериллий, как раз исключением не является. Возможны возбужденные состояния, то есть при подачи дополнительной энергии один из электронов S подуровня переходит на пустой свободный вакантный подуровень 2P,вот тогда уже спин валентность действительно равна 2 и формульному составу.
В полной мере отвечает BeH2 но далее возникает другая проблема, ведь если попытаться нарисовать как мы это делали в предыдущих примерах схему перекрывания орбиталнй, то получается что связи совершенно не однородные, совершенно различные по своей природе, потому что нужно будет рисовать двух Sорбиталей это одна геометрия и S и P
Орбитали это совсем другая история. А что говорит эксперимент, эксперимент свидетельствует в пользу того, что обе связи абсолютно равноценны и кроме того молекула BeH2 имеет линейную формулу, что у нас никак не получается. В свое время и метод валентных связей также стал между этими проблемами. Эксперимент и теория, одно другому не соответствует. Любая теория хороша до тех пор, пока это соответствие есть. Как только появляются экспериментальные факты не вмещающиеся в рамки этой теории и этого теоретического рассмотрения, значит теорию нужно изменять. Так и сделал метод ВС, он в себя дополнил представлениями о гибридизации атомных орбиталей. То есть было установлено и экспериментально подтверждение этому действительно имеется что в случае когда один неспаренный электрон S типа, а второй P между орбиталями соответствующей формы происходит явление, которое было названо гибридизация подобных орбиталей, то есть возникает некая усредненная поверхность, гибрид между S и Pорбиталью и вот эти гибридные орбитали как раз и участвуют в процессе образования химической связи. В зависимости от того сколько таких P орбиталей участвуют в этом процессе гибридизации различают 3 типа. SP гибрид SP2 гибрид иSP3 гибрид, Все возможные варианты. Один не спаренный P электрон, два не спаренных P электрона, три не спаренных P электрона.
| Исходные орбитали | Тип гибридизации | Геометрическая форма |
| SP | Линейная | |
| SP2 | Плоская треугольная | |
| SP3 | тетраэдрическая |
В каждом из этих случаев получается совершенно одинаковые гибридные орбитали. По форме они представляют собой нечто среднее между сферой и гантелеобразной Pорбиталью. Но количество таких P орбиталей будет разное. В первом случае, сколько мы затратили на образование гибридов столько мы и получим, затратили мы одну S и одну P и плучим 2 гибридных орбитали. Обозначение SP означает сколько орбиталей и какого типа в гибриде приняли участие. Итак, одна S и одна Pэто SP гибрид, одна орбиталь S и две орбитали P мы получаем с вами SP2 гибридное состояние и таких орбиталей три. Наконец если один не спаренный электрон S и три не спаренных электрона P, получается электрон SP3 типа, сколько орбиталей столько и обозначений SP3. Все они одинаковые, но количество их разное, и поэтому нужно расположить их в пространстве так, чтобы получилась максимально симметричная картинка. В первом случае всего две, с точки зрения геометрии более симметричные картинке нежели линейное расположение этих двух орбиталей друг относительно друга, вы получить не сможете в принципе, это максимально симметричный вариант. И поэтому, все молекулы в образовании которых принимают участие такие гибридные орбитали имеют линейную форму. Три гибридных орбитали SP 2 типа их 3 и опять же если подойди к проблеме как их нарисовать, с точки зрения максимальной симметрии, то ответ один, нужно вписать их в равно сторонний треугольник это геометрический критерий. Геометрия нам говорит о том, что нужно сделать так, чтобы получить максимальную симметрию. Равно сторонний треугольник, в центре ядро атома и к вершинам каждого угла смотрят одинаковые гибридные орбитали. И наконец в последнем варианте у нас четыре гибридных орбиталей уже более сложная конечно получится фигура геометрическая это тетраидр, то есть нам нужно вписать эти четыре гибридных орбитали в тетраидр, в центре ядро и к вершинам смотрят вот эти четыре гибридных орбитали. Итак, молекула имеет геометрию, которая запрограммирована в типе гибридизации орбиталей, принимающих участие в ее образовании. SP это линейная,SP2 равносторонний треугольник и SP3 это тетраидрическая форма молекулы. Значит можно и анализировать геометрию каждой молекулы произведя такие модельные, достаточно абстрактные построения, метод ВС как раз и отличается своей ценностью именно на этой почве. Он дает возможность анализировать геометрические параметры молекул и распределение электронной плотности. Поэтому в квантовой механике еще есть и второй метод он более математизирован, то есть он представляет собой сугубо математическую модель, но более перспективный, потому что он позволяет сделать расчет энергии состояния каждого электрона в молекуле. Итак, ковалентная связь, это связь которая образуется за счет общих электронных пар и мы можем этот процесс интерпретировать двумя методами. Первый простенький теории Льюиса, изображение в виде точки, и второй более современный, более строгий, квантово механический метод, метод валентных связей. Здесь уже можно говорить об орбиталях, о общей вероятности обнаружения электрона и строит эти схемы перекрывания орбитали. Итак, ковалентная связь полярная и не полярная, ионная связь, связь между ионами и электростатические притяжения, донорно-акцепторная связь, в природе своей ковалентная, но образующаяся немножко по другому механизму. И осталось рассмотреть еще две связи, но на самом таком ознакомительном уровне. Это связь водородная и связь металлическая. Что касается водородной связи, то она встречается достаточно редко и имеет очень выраженную специфику, это связь не между атомами в молекуле как предыдущие, а это связь, между молекулами в составе вещества. То есть эта связь является примером меж молекулярных взаимодействий. И самый популярный на тему водородных связей это конечно лед. Потому что молекулы воды в структуре льда связаны друг с другом именно такими водородными связями. То есть водородные связи, название подсказывает нам содержание, это связи за счет атомов водорода конечно, но этого условия не достаточно. На атоме водорода должен быть достаточно большой положительный заряд, вот в полярных молекулах, а именно к этому разряду относится молекулы воды, как раз заряд на атоме водорода достаточно большой. И мы можем говорить о электростатических взаимодействиях и о донорно-акцепторных, потому что атом кислорода в воде имеет две не поделенные, то есть не участвующие в образовании связи между атомами электронные пары, это предает ему донорные свойства. Итак, каждая молекула воды, может образовать вот такие водородные, особенные межмолекулярные связи с четырьмя соседними молекулами. Если представить это себе в объеме, а не в плоскости, то можно прейти к выводу что это тетраидр, потому что все эти связи по длине одинаковы. То есть, лед имеет тетраидрическую структуру, самая уникальная тетраидрическая структура, свойственно алмазу, всем известны его отличительные особенности, как вещества, это во-первых твердость, а во вторых кристаллическая структура. То есть внешний вид этого вещества, не говорим уже о бриллиантах то есть ограненных алмазах, уже говорит о том, что его структура очень высоко упорядоченная. Вода, конечно не может образовать такие же связи между своими молекулами как в алмазе, но тем не менее говорят что в структуре льда алмазо подобная структура, то есть геометрически она построена точно также. Ну вот только если в атоме углерода в алмазе очень короткие, очень жесткие, очень устойчивые, ковалентные, не полярные связи и поэтому структура сверх стабильна, то конечно в структуре льда связи не стабильные, рыхлые, длинные и гораздо более слабые. Поэтому 0 градусов как вы знаете и лед плавится, переходит в жидкое состояние, но тем не менее алмазо подобность какая то в этой структуре безусловно присутствует. Наверно поэтому на солнце в зимнее время лед искрится и всячески эту структуру доказывает. Итак, пример водородных меж молекулярных связей, это полярные молекулы, которые за счет этой полярности, за счет высокого положительного заряда на атомах водорода, может образовывать связи между молекулами. Наконец последний вид связи металлическая. Опять же название дает полную подсказку о природе этой связи, эта связь в металлах, металлическая связь, это связь в особом классе веществ которые называются металлы. Металлы отличаются и внешним видом и по свойствам достаточно резко от всех других, даже по внешнему виду металлы распознать довольно легко. Так называемый металлический блеск, это первое что бросается в глаза и по этой причине даже самая простая модель металлической структуры конечно должна это все объяснять и металлический блеск и высокую теплопроводность и высокую электропроводность. Самый простой вариант объяснения металлической структуры, это некая модель, которая пытается представить металлическую связь как совокупность и ионных взаимодействий и ковалентных взаимодействий одновременно, то есть некоторый момент промежуточный с элементами и ковалентной и ионной связей. В узлах решетки находятся ионы, положительно заряженные катионы металла, а в пространстве между узлами находятся электроны в свободном состоянии, которые постоянно перемещаются. Так называемый электронный газ, перемещаются свободным образом, то есть хаотически. рисунок
Плотная упаковка катионов имеет место и поэтому отражательная способность с высока, вот вам объяснение металлического блеска и наличие совершенно свободных электронов которые под действием внешних полей могут направленно перемещаться, вот и объяснение второго вида свойств, высокая тепло электропроводность. На квантово механическом уровне металлическую структуру нужно объяснять с позиции так называемой зонной теории, о которой вы сможете прочитать в учебнике. Итак, металлическая связь, это связь в металлах простых веществах, железо, золото, серебро, магний, алюминий, и т.д. речь идет не о соединении с металлами других соединений, а о простых веществах. Итак, распознать вид связи, это первое умение которое требуется в рамках этой темы, второе определить для ковалентной связи кратность воспользовавшись теорией Льюиса и прикинув электронную схему. Посмотрев в таблицу Менделеева и определив сколько же электронов не достает атому данного элемента до актета и полностью проанализировать геометрические особенности ковалентной молекулы в рамках метода валентных связей. Вот перечень основных умений, которые подразумевает освоение этой темы.
4.2.3. σ-, π-Связи
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или -типу.
· σ -Связь – ковалентная связь, образованная при перекрывании s -, p - и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
· π -Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р -АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
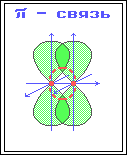
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р -АО.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
1. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами.
2. По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи (аним., ~33 Kб). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи!
3. Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
4. Сигма- и пи-связи (- и -связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметриейраспределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующихатомов. Результирующее электронное облако -связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующихатомов. Простые связи в химических соединениях обычно являются (т-связями (см. Простая связь). Электронное облако -связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. Употребление греческих букв и связано с соответствием их латинским буквам s и р в обозначении электронов атома, при участии которых впервые появляется возможность для образования - и -связей соответственно. Поскольку облака атомных р-орбиталей (px, ру, pz) симметричны относительно соответствующих осей декартовых координат (х, у, z), то, если одна р-орбиталь, например pz, принимает участие в образовании -связи (ось z — линия связи), две оставшиеся р-орбитали (px, py) могут принять участие в образовании двух -связей (их узловые плоскости будут yz и xz соответственно; см. рис. 2). В образовании и -связей могут принять участие также d- (см. рис. 1) и f-электроны атома.
5. Если между атомами в молекуле возникают одновременно как -, так и -связи, то результирующая связь является кратной (см. Кратные связи,Двойная связь, Тройная связь, а также Валентность).
Вопрос
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». [1]
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании».
В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[9]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
§ энергия ионизации атомов;
§ энергия сродства атомов к электрону;
§ электроотрицательность;
§ атомные (и ионные) радиусы;
§ энергия атомизации простых веществ
§ степени окисления;
§ окислительные потенциалы простых веществ.
[править]Проявления периодического закона в отношении энергии ионизации

Рис. 1 Зависимость энергии ионизацииатомов от порядкового номера элемента.
Зависимость энергии ионизации атома от порядкового номера элемента (рис. 1) носит отчетливо периодический характер. Легче всего удалить электрон из атомов щелочных металлов, включающих по одному валентному электрону, труднее всего — из атомов благородных газов, обладающих замкнутой электронной оболочкой. Поэтому периодичность изменения энергии ионизации атомов характеризуется минимумами, отвечающими щелочным металлам, и максимумами, приходящимися на благородные газы. Наряду с этими резко выраженными минимумами и максимумами на кривой энергии ионизации атомов наблюдаются слабо выраженные минимумы и максимумы, которые по-прежнему нетрудно объяснить с учетом упомянутых эффектов экранирования и проникновения, эффектов межэлектронных взаимодействий и т. д[10].
[править]Проявления периодического закона в отношении энергии сродства к электрону

Рис. 2 Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)
Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов (см. определение энергии сродства к электрону).
Наибольшим сродством к электрону обладают p -элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s² (Be, Mg, Zn) и s²p6 (Ne, Ar) или с наполовину заполненными p -орбиталями (N, P, As)[11]:
| Li | Be | B | C | N | O | F | Ne | |
| Электронная конфигурация | s1 | s² | s²p1 | s²p² | s²p³ | s²p4 | s²p5 | s²p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
[править]Проявления периодического закона в отношении электроотрицательности

Рис. 3 Шкала электроотрицательности по Полингу
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселенности, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остается необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону[12].
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы.
[править]Проявления периодического закона в отношении атомных и ионных радиусов

Рис. 4 Зависимость орбитальных радиусов атомов от порядкового номера элемента.
Периодический характер изменения размеров атомов и ионов известен давно. Сложность здесь состоит в том, что из-за волновой природы электронного движения атомы не имеют строго определенных размеров. Так как непосредственное определение абсолютных размеров (радиусов) изолированных атомов невозможно, в данном случае часто используют их эмпирические значения. Их получают из измеренных межъядерных расстояний в кристаллах и свободных молекулах, разбивая каждое межъядерное расстояние на две части и приравнивая одну из них к радиусу первого (из двух связанных соответствующей химической связью) атома, а другую — к радиусу второго атома. При таком разделении учитывают различные факторы, включая природу химической связи, степени окисления двух связанных атомов, характер координации каждого из них и т. д[13]. Таким способом получают так называемые металлические, ковалентные, ионные и ван-дер-ваальсовы радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов; их находят по межъядерным расстояниям в твердых или жидких веществах, где атомы находятся в непосредственной близости друг от друга (например, атомы Ar в твердом аргоне или атомы N из двух соседних молекул N2 в твердом азоте), но не связаны между собой какой-либо химической связью.
Но, очевидно, лучшим описанием эффективных размеров изолированного атома является теоретически рассчитанное положение (расстояние от ядра) главного максимума зарядовой плотности его наружныхэлектронов. Это так называемый орбитальный радиус атома. Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчетливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда Li—Ne, немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов. В больших периодах в семействах d- и f- элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред- предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
[править]Проявления периодического закона в отношении энергии атомизации
Энергия атомизации простых веществ является характеристикой, которая во многом определяет их реакционную способность[14]. Зависимость энергии атомизации простых веществ от порядкового номера элемента имеет периодический характер. Основные моменты такой периодической зависимости состоят в следующем: энергия атомизации растет при переходе от щелочного металла (для них эти значения сравнительно невелики и близки 84 кДж/моль) к следующим за ним элементам, достигает максимума, затем убывает, становясь очень небольшой для галогена (63—126 кДж/моль) и, наконец, превращается в нуль в случае примыкающего к галогену благородного газа, который, как известно, при стандартных условиях существует в виде практически не взаимодействующих атомов. Положение максимума энергии атомизации в ряду элементов от щелочного металла до соответствующего (ближайшего) благородного газа зависит от многих факторов, выходящих за рамки настоящего изложения. Так, в ряду Li—Neнаибольшей энергией атомизации характеризуется углерод (718,2 кДж/моль), а в рядах K—Kr и Cs—Rn наибольшими энергиями атомизации обладают переходные металлы: ванадий (516,6 кДж/моль) и вольфрам (844,2 кДж/моль). Неравномерное изменение энергии атомизации в пределах одного ряда элементов от щелочного металла до благородного газа оказывается довольно сложным, особенно если этот ряд включает семейство переходных металлов.
[править]Проявления периодического закона в отношении степени окисления
Одним из основных понятий в химии было и остается понятие степени окисления (степень окисления, состояние окисления, окислительное состояние). Несмотря на то что степень окисления представляется во многом формальной и более искусственной относительно других традиционных химических понятий, она до сих пор остается широко распространенной и сохраняет свою значимость для обобщения и более глубокого понимания основных принципов образования химических соединений[15].
Следует подчеркнуть, что степень окисления элемента, будучи формальной характеристикой, не дает представления ни об эффективных зарядах атомов этого элемента в соединении, ни о валентности атомов, хотя степень окисления часто называют формальной валентностью. Многие элементы способны проявлять не одну, а несколько различных степеней окисления. Например, для хлора известны все степени окисления от −1 до +7, хотя четные очень неустойчивы, а для марганца — от +2 до +7. Высшие значения степени окисления изменяются в зависимости от порядкового номера элемента периодически, но эта периодичность имеет сложный характер. В простейшем случае в ряду элементов от щелочного металла до благородного газа высшая степень окисления возрастает от +1 (RbF) до +8 (XeО4). В других случаях высшая степень окисления благородного газа оказывается меньше (Kr+4F4), чем для предшествующего галогена (Br+7О4−). Поэтому на кривой периодической зависимости высшей, степени окисления от порядкового номера элемента максимумы приходятся или на благородный газ, или на предшествующий ему галоген (минимумы — всегда на щелочной металл). Исключение составляет ряд Li—Ne, в котором ни для галогена (F), ни для благородного газа (Ne) вообще неизвестны высокие степени окисления, а наибольшим значением высшей степени окисления обладает средний член ряда — азот; поэтому в ряду Li—Ne изменение высшей степени окисления оказывается проходящим через максимум. В общем случае возрастание высшей степени окисления в ряду элементов от щелочного металла до галогена или до благородного газа происходит отнюдь не монотонно, главным образом по причине проявления высоких степеней окисления переходными металлами. Например, возрастание высшей степени окисления в ряду Rb—Xe от +1 до +8 «осложняется» тем, что для молибдена, технеция и рутения известны такие высокие степени окисления, как +6 (MoО3), +7 (Tc2О7), +8 (RuO4).
[править]Проявления периодического закона в отношении окислительного потенциала
Одной из очень важных характеристик простого вещества является его окислительный потенциал, отражающий принципиальную способность простого вещества к взаимодействию с водными растворами, а также проявляемые им окислительно-восстановительные свойства[16]. Изменение окислительных потенциалов простых веществ в зависимости от порядкового номера элемента также носит периодический характер. Но при этом следует иметь в виду, что на окислительный потенциал простого вещества оказывают влияние различные факторы, которые иногда нужно рассматривать индивидуально. Поэтому периодичность в изменении окислительных потенциалов следует интерпретировать очень осторожно.
| Na/Na+(aq) | Mg/Mg2+(aq) | Al/Al3+(aq) |
| 2,71В | 2,37В | 1,66В |
| K/K+(aq) | Ca/Ca2+(aq) | Sc/Sc3+(aq) |
| 2,93В | 2,87В | 2,08В |
Можно обнаружить некоторые определенные последовательности в изменении окислительных потенциалов простых веществ. В частности, в ряду металлов при переходе от щелочного к следующим за ним элементам происходит уменьшение окислительных потенциалов (Na+(aq) и т. д. — гидратированный катион):
Это легко объясняется увеличением энергии ионизации атомов с увеличением числа удаляемых валентных электронов. Поэтому на кривой зависимости окислительных потенциалов простых веществ от порядкового номера элемента имеются максимумы, отвечающие щелочным металлам. Но это не единственная причина изменения окислительных потенциалов простых веществ.
[править]Внутренняя и вторичная периодичность
[править] s - и р -элементы
Выше рассмотрены общие тенденции в характере изменения значений энергии ионизации атомов, энергии сродства атомов к электрону, электроотрицательности, атомных иионных радиусов, энергии атомизации простых веществ, степени окисления, окислительных потенциалов простых веществ от атомного номера элемента. При более глубоком изучении этих тенденций можно обнаружить, что закономерности в изменении свойств элементов в периодах и группах значительно сложнее. В характере изменения свойств элементов по периоду проявляется внутренняя периодичность, а по группе — вторичная периодичность (открыта Е. В. Бироном в 1915 году).
Так, при переходе от s-элемента I группы к р -элементу VIII группы на кривой энергии ионизации атомов и кривой изменения их радиусов имеются внутренние максимумы и минимумы[17] (см. рис. 1, 2, 4).
Это свидетельствует о внутреннепериодическом характере изменения этих свойств по периоду. Объяснение отмеченных закономерностей можно дать с помощью представления об экранировании ядра.
Эффект экранирования ядра обусловлен электронами внутренних слоев, которые, заслоняя ядро, ослабляют притяжение к нему внешнего электрона. Так, при переходе от бериллия 4Be к бору 5B, несмотря на увеличение заряда ядра, энергия ионизации атомов уменьшается:

Рис. 5 Схема строения последних уровней бериллия, 9.32 эВ (слева) и бора, 8,29 эВ (справа)
Это объясняется тем, что притяжение к ядру 2р -электрона атома бора ослаблено за счет экранирующего действия 2s -электронов.
Понятно, что экранирование ядра возрастает с увеличением числа внутренних электронных слоев. Поэтому в подгруппах s - и р -элементов наблюдается тенденция к уменьшению энергии ионизации атомов [18](см. рис. 1).
Уменьшение энергии ионизации от азота 7N к кислороду 8О (см. рис. 1) объясняется взаимным отталкиванием двух электронов одной и той же орбитали:

Рис. 6 Схема строения последних уровней азота, 14,53 эВ (слева) и кислорода, 13,62 эВ (справа)
Эффектом экранирования и взаимного отталкивания электронов одной орбитали объясняется также внутреннепериодический характер изменения по периоду атомных радиусов (см. рис. 4).

Рис. 7 Вторичнопериодическая зависимость радиусов атомов внешних p-орбиталей от атомного номера

Рис. 8 Вторичнопериодическая зависимость первой энергии ионизации атомов от атомного номера

Рис. 9 Радиальное распределение электронной плотности в атоме натрия
В характере изменения свойств s - и р -элементов в подгруппах отчетливо наблюдается вторичная периодичность (рис. 7). Для её объяснения привлекается представление о проникновении электронов к ядру. Как показано на рисунке 9, электрон любой орбитали определенное время находится в области, близкой к ядру. Иными словами, внешние электроны проникают к ядру через слои внутренних электронов. Как видно из рисунка 9, внешний 3 s -электрон атома натрия обладает весьма значительной вероятностью находиться вблизи ядра в области внутренних К - и L -электронных слоев.
Концентрация электронной плотности (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s -электрона, меньше — для р -электрона, ещё меньше — для d -электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3 s >3 p >3 d (см. рис. 10).

Рис. 10 Радиальное распределение вероятности нахождения электрона (электронной плотности) на расстоянии r от ядра
Понятно, что эффект проникновения увеличивает прочность связи внешних электронов с ядром. Вследствие более глубокого проникновения s -электроны в большей степени экранируют ядро, чем р -электроны, а последние — сильнее, чем d -электроны, и т. д.
Пользуясь представлением о проникновении электронов к ядру, рассмотрим характер изменения радиуса атомов элементов в подгруппе углерода. В ряду C—Si—Ge—Sn—Pb проявляется общая тенденция увеличения радиуса атома (см. рис. 4, 7). Однако это увеличение имеет немонотонный характер. При переходе от Si к Ge внешние р -электроны проникают через экран из десяти 3 d -электро-нов и тем самым упрочняют связь с ядром и сжимают электронную оболочку атома. Уменьшение размера 6 p -орбитали Pb по сравнению с 5 р -орбиталью Sn обусловлено проникновением 6 p -электронов под двойной экран десяти 5 d -электронов и четырнадцати 4 f -электронов. Этим же объясняется немонотонность в изменении энергии ионизации атомов в ряду C—Pb и большее значение её для Pb по сравнению с атомом Sn (см. рис. 1).
[править] d -Элементы
Во внешнем слое у атомов d -элементов (за исключениемPd) находятся 1—2 электрона (ns -состояние). Остальные валентные электроны расположены в (n—1) d -состоянии, т. е. в предвнешнем слое.
Подобное строение электронных оболочек атомов определяет некоторые общие свойства d -элементов[19]. Так, их атомы характеризуются сравнительно невысокими значениями первой энергии ионизации. Как видно на рисунке 1, при этом характер изменения энергии ионизации атомов по периоду в ряду d -элементов более плавный, чем в ряду s - и p -элементов. При переходе от d -элемента III группы к d -элементу II группы значения энергии ионизации изменяются немонотонно. Так, на участке кривой (рис. 1) видны две площадки, соответствующие энергии ионизации атомов, в которых заполняются З d -орбитали по одному и по два электрона. Заполнение 3 d -орбиталей по одному электрону заканчивается у Mn (3d54s2), что отмечается некоторым повышением относительной устойчивости 4s2-конфигурации за счет проникновения 4s2-электронов под экран 3d5-конфигурации. Наибольшее значение энергии ионизации имеет Zn (3d104s2), что находится в соответствии с полным завершением З d -подслоя и стабилизацией электронной пары за счет проникновения под экран 3 d 10-конфигурации.
В подгруппах d -элементов значения энергии ионизации атомов в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру. Так, если у d -элементов 4-го периода внешние 4 s -электроны проникают под экран 3 d -электронов, то у элементов 6-го периода внешние 6 s -электроны проникают уже под двойной экран 5 d - и 4 f -электронов. Например:
| 22Ti …3d24s2 | I = 6,82 эВ |
| 40Zr …3d104s24p64d25s2 | I = 6,84 эВ |
| 72Hf… 4d104f145s25p65d26s2 | I = 7,5 эВ |
Поэтому у d -элементов 6-го периода внешние б s -электроны связаны с ядром более прочно и, следовательно, энергия ионизации атомов больше, чем у d -элементов 4-го периода.
Размеры атомов d -элементов являются промежуточными между размерами атомов s - и p -элементов данного периода. Изменение радиусов их атомов по периоду более плавное, чем для s - и p -элементов.
В подгруппах d -элементов радиусы атомов в общем увеличиваются. Важно отметить следующую особенность: увеличение атомных и ионных радиусов в подгруппах d -элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы атомов d -элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f -сжатием, вызванным заполнением электронами 4 f -подслоя у f -элементов 6-го периода. В этом случае f -сжатие называется лантаноидным. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов и ионов для d -элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Отмеченным закономерностям не подчиняются элементы подгруппы скандия. Для этой подгруппы типичны закономерности, характерные для соседних подгрупп s -элементов.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражениемпериодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Вопрос
Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4 в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов.
 2018-01-21
2018-01-21 3770
3770
