Качественный и количественный состав растворов
Раствор - это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации.
Жидкие растворы (в дальнейшем будем называть их просто "растворами") состоят из жидкого растворителя (чаще всего воды) и растворенного вещества, которое до смешения с растворителем могло быть твердым (например KBr), жидким (например H2SO4) или газообразным (например CO2).
Состояние веществ в водном растворе обозначается (р), например KBr(р).
Состав растворов обычно передается содержанием в нем растворенного вещества в виде массовой доли или молярной концентрации.
Массовая доля и молярная концентрация растворённого вещества
Массовая доля w В растворенного вещества В - это отношение его массы m B к массе раствора m (р):
w В = m B / m (р), где m (р) = m B + m (Н2О).
Единица массовой доли вещества в растворе - доля от единицы или от 100%.
Например, если в 100 г раствора находится 1 г KBr, то w (KBr) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды.
Плотность воды при комнатной температуре принимают равной 1 г/мл, поэтому удобнее отмерять 99 мл воды и добавить 1 г соли.
Молярная концентрация с В растворённого вещества В - это отношение количества этого вещества n В к объему раствора V (р): с В = n В / V (р). Единица молярной концентрации вещества в растворе: моль/л.
Например, если в 1 л раствора содержится 1 моль KBr, то с (KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор.
Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды.
Объем раствора V (р) при данной температуре связан с массой раствора m (р) и его плотностью (ρ) следующим образом: m (р) = ρ · V (р).
Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
Теоретическая часть
Растворы – это гомогенные (однофазные) химические системы переменного состава, образованные двумя или несколькими веществами. Жидкие растворы (в дальнейшем будем называть просто «растворы») состоят из жидкого растворителя (в неорганической химии чаще всего из воды) и одного или нескольких растворенных веществ, которые до смешения с растворителем могли быть твердыми, жидкими или газообразными. Далее будем рассматривать растворы с одним растворенным веществом.
Состав раствора определяется количествами растворенного вещества и растворителя. Различают разбавленные и концентрированные растворы, которые содержат соответственно меньшее и большее количество растворенного вещества. Концентрированными растворами часто называют такие растворы, в которых количество растворенного вещества значительно превышает количество растворителя.
В неорганической химии для количественного выражения состава растворов используют массовую долю, молярную концентрацию и эквивалентную концентрацию. Все определения, приведенные ниже для водных растворов, легко распространить и на неводные растворы.
Массовая доля w B растворенного вещества В – это отношение его массы mв к сумме масс растворенного вещества и растворителя – воды (т.е. к массе раствора):
w B= m B / m (р)= m B / (m B + m воды) =
= m B / { V (p) ρ(р)} = m B / (m B + V воды ρводы),
где ρ(р) – плотность раствора; V (p) объем раствора; V воды – объем воды и ρводы плотность воды (можно принять, что при комнатной температуре ρводы равна 1 г/мл).
Раствор, в котором массовая доля растворенного вещества равна w B(%), характеризуется тем же значением процентного содержания. Например, раствор с массовой долей хлороводорода w HCl = 0,2 (т.е. 20%) может быть обозначен как 20%-ный раствор HCl (20-процентный растворхлороводорода в воде).
См учебник
Вопрос
Комплексные соединения (лат. complexus — сочетание, обхват), или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
| Содержание [убрать] · 1 Основные термины · 2 Классификация o 2.1 По заряду комплекса o 2.2 По числу мест занимаемых лигандами в координационной сфере o 2.3 По природе лиганда · 3 Номенклатура · 4 История · 5 Структура и стереохимия · 6 Изомерия координационных соединений o 6.1 Пространственная (геометрическая) изомерия o 6.2 Оптическая изомерия · 7 Электронные свойства o 7.1 Окраска o 7.2 Магнитные свойства · 8 Применение · 9 Ссылки · 10 Литература · 11 Примечания · 12 См. также |
[править]Основные термины
Комплексное соединение – химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия " комплексная частица" нет. Обычно используется следующее определение.
Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы подонорно-акцепторному механизму.
Комплексообразователь – центральный атом комплексной частицы. Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атомкислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды – атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью), бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три-, тетрадентатные и т.д.
Координационный полиэдр – воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах – частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) – число - связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов - числу таких лигандов, умноженному на дентатность.
[править]Классификация
Существует несколько классификации комплексных соединений в основу которых положены различные принципы.
[править]По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl3 — хлорид гексоамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а так же при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
[править]По числу мест занимаемых лигандами в координационной сфере
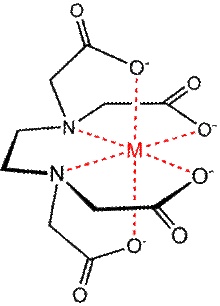

Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своем составе несколько групп −С≡Nили −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
[править]По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
[править]Номенклатура
1) В названии комплексного соединения первым указывают анион|отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Дляполидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитрохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
[править]История
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866-1919). Координационная теория Вернера 1893 года была первой попыткой объяснить структуру комплексных соединений. Эта теория была предложена до открытия электрона Томсоном в 1896 году, и до разработки электронной теории валентности. Вернер не имел в своём распоряжении никаких инструментальных методов исследований, а все его исследования были сделаны интерпретацией простыххимических реакций.


Альфред Вернер
Представления о возможности существования «дополнительных валентностей», зародившиеся при изучении четвертичных аминов, Вернер применяет и к «комплексным соединениям». В статье «К теории сродства и валентности», опубликованной в 1891 г., Вернер определяет сродство как «силу, исходящую из центра атома и равномерно распространяющуюся во всех направлениях, геометрическое выражение которой, таким образом, представляет собой не определенное число основных направлений, а сферическую поверхность». Два года спустя в статье «О строении неорганических соединений» Вернер выдвинул координационную теорию, согласно которой в неорганических молекулярных соединениях центральное ядро составляют комплексообразующие атомы. Вокруг этих центральных атомов расположено в форме простого геометрического полиэдра определенное число других атомов или молекул. Число атомов, сгруппированных вокруг центрального ядра, Вернер назвал координационным числом. Он считал, что при координационной связи существует общая пара электронов, которую одна молекула или атом отдает другой. Поскольку Вернер предположил существование соединений, которые никто никогда не наблюдал и не синтезировал, его теория вызвала недоверие со стороны многих известных химиков, считавших, что она без всякой необходимости усложняет представление о химической структуре и связях. Поэтому в течение следующих двух десятилетий Вернер и его сотрудники создавали новые координационные соединения, существование которых предсказывалось его теорией. В числе созданных ими соединений были молекулы, обнаруживающие оптическую активность, т.е. способность отклонять поляризованный свет, но не содержащие атомов углерода, которые, как полагали, были необходимы для оптической активности молекул.
В 1911 г. осуществление Вернером синтеза более чем 40 оптически активных молекул, не содержащих атомов углерода, убедило химическое сообщество в справедливости его теории.
В 1913 г. Вернеру была присуждена Нобелевская премия по химии «в знак признания его работ о природе связей атомов в молекулах, которые позволяли по-новому взглянуть на результаты ранее проведенных исследований и открывали новые возможности для научно-исследовательской работы, особенно в области неорганической химии». По словам Теодора Нордстрема, который представлял его от имени Шведской королевской академии наук, работа Вернера «дала импульс развитию неорганической химии», стимулировав возрождение интереса к этой области после того, как она какое-то время пребывала в забвении.
[править]Структура и стереохимия
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатомНобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно являетсякатион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счет неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
а) полярные молекулы — NH3, Н2О, CO, NO;
б) простые ионы — F−, Cl−, Br−, I−, H+;
в) сложные ионы — CN−, SCN−, NO2−, OH−.
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Стереохимический подход — удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
[править]Изомерия координационных соединений
В статистическом аспекте стереохимии центральным оказывается явление изомерии координационных соединений. Свойство изомерии химических соединений было известно еще при разработке классической теории химического строения. Изомерия молекул открыта в 1823 г. Ю.Либихом, обнаружившим, что серебряная соль гремучей кислоты и изоцианат серебра имеют один и тот же элементный состав, но разные физические и химические свойства.
Под изомерией понимают способность к разному взаимному расположению атомов и атомных фрагментов в соединениях одинакового общего состава, диктующую отличия в химических и физических свойствах соответствующих соединений — изомеров. В случае координационных соединений указанные различия могут быть связаны как со спецификой расположения лигандов во внутренней координационной сфере, так и с распределением лигандов между внутренней и внешними сферами.
Изомерия прямо связана с наличием или отсутствием в соединении тех или иных элементов симметрии: поворотных осей, зеркально-поворотных осей, центра и плоскостей симметрии.
Стереохимическая конфигурация характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения. Смысл этого термина зависит от конкретного пространственного расположения атомов в структуре комплекса. Его используют для описания фигуры или многогранника вместе с дополнительным определением, характеризующим специфику пространственного расположения атомов. Так, можно говорить о цис- или транс-конфигурации; D (d), L(l), DL (dl) — соответственно право-, левовращающая конфигурация, рацемат.
Существуют изомеры двух типов:
1) соединения, в которых состав внутренней сферы и строение координированных лигандов идентичны (геометрические, оптические, конформационные, координационного положения);
2) соединения, для которых возможны различия в составе внутренней сферы и строении лигандов (ионизационные, гидратные, координационные, лигандные).
[править]Пространственная (геометрическая) изомерия
Этот вид изомерии вызван неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров.
§ 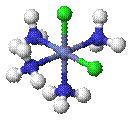
цис -[CoCl2(NH3)4]+
§ 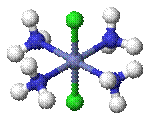
транс -[CoCl2(NH3)4]+
§ 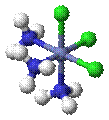
Гран- (fac-) граневой -[CoCl3(NH3)3]
§ 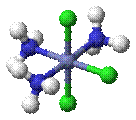
Ос- (mer-) реберный -[CoCl3(NH3)3]
[править]Оптическая изомерия
Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда еще зеркальной изомерией.
§ 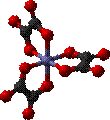
Λ-[Fe(ox)3]3−
§ 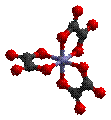
Δ-[Fe(ox)3]3−
§ 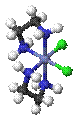
Λ- цис -[CoCl2(en)2]+
§ 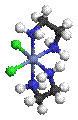
Δ- цис -[CoCl2(en)2]+
Гидратная (сольватная) изомерия заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем. Например: [Cr(H2O)6]Cl3 (фиолетовый), [Cr(H2O)5Cl]Cl2 ∙ H2O (светло-зеленый), [Cr(H2O)Cl2]Cl ∙ 2H2O (темно-зеленый).
Ионизационная изомерия определяется различным распределением заряженных лигандов между внутренней и внешней сферами комплекса и характеризует способность координационных соединений с одним и тем же элементным составом давать в растворе разные ионы. Примеры соединений: [Co(NH3)5Br]SO4 (красно-фиолетовый), [Co(NH3)5SO4]Br (красный).
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
[править]Электронные свойства
[править]Окраска
Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d-орбиталей появляется возможность перехода электроновс подуровней dxy, dzy, dxz на вакантные подуровни с более высокой энергией dz2,dz2-y2 под действием поглощаемых квантов света. Эти явления можно наблюдать с помощьюэлектронной спектроскопии. В зависимости от разности расщепленных уровней комплексы поглощают кванты света определенных диапазонов длин волн, поэтому имеют соответствующую окраску.
| Примеры комплексных соединений различных цветов | ||||||
| FeII | FeIII | CoII | CuII | AlIII | CrIII | |
| Гидратированный ион | [Fe(H2O)6]2+ Бледно-зеленый | [Fe(H2O)6]3+ Желто-коричневый | [Co(H2O)6]2+ Розовый | [Cu(H2O)6]2+ Серо-голубой | [Al(H2O)6]3+ Бесцветный | [Cr(H2O)6]3+ Бледно-зеленый |
| OH–, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зеленый | [Fe(H2O)3(OH)3] Коричневый | [Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(H2O)3(OH)3] Белый | [Cr(H2O)3(OH)3] Зеленый |
| OH–, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зеленый | [Fe(H2O)3(OH)3] Коричневый | |[Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(OH)4]– Бесцветный | [Cr(OH)6]3– Бледно-зеленый |
| NH3, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зеленый | [Fe(H2O)3(OH)3] Коричневый | [Co(H2O)4(OH)2] Голубой | [Cu(H2O)4(OH)2] Синий | [Al(H2O)3(OH)3] Белый | [Cr(H2O)3(OH)3] Зеленый |
| NH3, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зеленый | [Fe(H2O)3(OH)3] Коричневый | [Co(NH3)6]2+ Желтый | [Cu(NH3)4(H2O)2]2+| Темно-синий | [Al(H2O)3(OH)3] Белый | [Cr(NH3)6]3+ Бледно-зеленый |
| CO32– | FeCO3 Светло-зеленый | [Fe(H2O)3(OH)3] Коричневый | CoCO3 Розовый | CuCO3 Голубой |
[править]Магнитные свойства
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные, по разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренныхэлектронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ -подуровни.
1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).
2. Сначала заполняются орбитали, имеющие меньшую энергию.
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие атомная орбиталей, уже заполненных одним электроном, либо заполнение свободных dγ –орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором - для перехода на орбиталь более высокой энергии. Распределение электронов по орбиталям зависит от соотношения между величинами энергий расщепления (Δ) и спаривания электронов (Р). При низких значениях Δ («слабое поле»), величина Δ может быть < Р, тогда электроны займут разные орбитали, аспины их будут параллельны. При этом образуются внешнеорбитальные (высокоспиновые) комплексы, характеризующиеся определенным магнитным моментом µ. Если энергия межэлектронного отталкивания меньше, чем Δ ("сильное поле"), т.е. Δ > Р, происходит спаривание электронов на dε -орбиталях и образование внутриорбитальных (низкоспиновых) комплексов, магнитный момент которых µ =0.
[править]Применение
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофиллнаходящийся в растениях является комплексом.
Комплексные соединения находят широкое применение в различных отраслях промышленности. Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода. Метод извлечения золота из руд с помощью растворов цианидов был предложен в 1843 г. русским инженером П. Багратионом. Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов. Эти соединения - летучие жидкости, легко разлагающиеся с выделением соответствующих металлов.
Широкое применение комплексные соединения получили в аналитической химии в качестве индикаторов.
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, металлов, фотоматериалов, катализаторов, надежных средств для переработки и консервирования пищи и т.д.
Комплесные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов.
 2018-01-21
2018-01-21 4320
4320
