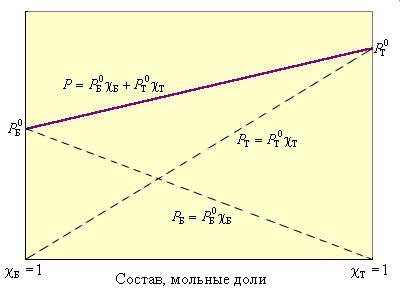
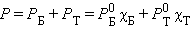По термодинамическому признаку растворы делятся на идеальные и реальные. Для идеальных растворов предполагается, что между компонентами раствора любыми взаимодействиями можно пренебречь. Следовательно, любое свойство растворяемых веществ при их смешении не должно меняться. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Рауля будет аддитивной величиной
|
Здесь 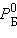 и
и 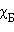 ,
, 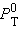 и
и 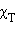 – соответственно давление и мольные доли бензола и толуола.
– соответственно давление и мольные доли бензола и толуола.
|
| Рисунок 6.1 Зависимость давления пара над смесью бензол–толуол от мольной доли |
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют идеальным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ → 0. Во всех прочих случаях раствор считается реальным.
Взаимодействие между компонентами раствора, выражаемое через энтальпию сольвации Δ H сольв, служит в определенных пределах мерой идеальности раствора.Д. И. Менделеев показал, что взаимодействие между компонентами раствора может рассматриваться как химический процесс образования соединений переменного состава – сольватов. Этот подход лежит в основе химической или сольватной теории растворов. Если при кристаллизации твердая фаза содержит молекулы растворителя, то ее называют кристаллосольватом.
НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав к-рых может изменяться непрерывным образом (по крайней мере, в нек-рых пределах). В отличие от растворов электролитов, в растворах неэлектролитов (мол. р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. В данной статье рассматриваются жидкие р-ры; см. также Твердые растворы.
Взаимная р-римость двух жидкостей при заданных т-ре Т и давлении р м. б. полной (неограниченной) или ограниченной. В последнем случае р-ры в нек-рой области составов расслаиваются, т. е. разделяются на две жидкие фазы, отличающиеся по концентрации. В многокомпонентных расслаивающихся р-рах число сосуществующих жидких фаз м. б. более двух. Если один (или более) из компонентовраствора неэлектролитов в чистом состоянии при заданных Т и р является газом или твердым телом, область существования растворанеэлектролитов простирается от чистой жидкости (смеси жидкостей), выступающей в роли р-рителя, до состава, отвечающего насыщ. р-ру.
Растворы неэлектролитов служат средой, в к-рой протекают многие прир. и пром. процессы. Изучение и прогнозирование св-в этих систем тесно связаны с такими практич. проблемами, как подбор р-рителей для реализации технол. процессов, получение систем с заданными св-вами, разделение прир. и пром. смесей (включая газы и нефти), глубокая очистка в-в.
Физ. химия изучает широкий диапазон св-в р-ров. Наиб. разработана и имеет практически важные применения равновеснаятермодинамика р-ров; дальнейший материал посвящен в осн. этому разделу физ. химии р-ров. Кроме того, изучаются транспортные св-ва р-ров-диффузия, теплопроводность, вязкость (см. Физико-химическая гидродинамика), а также спектроскопич., электрич., акустич. и др. физ. св-ва. Методы исследования макроскопич. св-в растворов неэлектролитов и их структурных характеристик во многом аналогичны методам исследования индивидуальных жидкостей, но осн. внимание уделяется рассмотрению концентрац. зависимостей св-в. Важнейшая задача физ.-хим. исследований - установление связи между наблюдаемыми на опыте св-вами, структурой р-ров и характеристиками межмолекулярных взаимодействий. Эксперим. информацию о структуре р-ров и межмолекулярных взаимод. в них дают методы оптической и радиоспектроскопии, дифракционные, электрич. и др. Важную роль в изучении растворов неэлектролитов играет физико-химический анализ, основанный на построении и исследовании фазовых диаграмм, концентрац. зависимостей термодинамич. и др. физ. св-в (показателя преломления, вязкости, теплопроводности, акустич. характеристик и др.). При этом одна из главных задач состоит в том, чтобы на основании анализа диаграмм состав - свойство устанавливать факт образования хим. соединений между компонентами растворов неэлектролитов и находить их характеристики.
Значит. влияние на физ. св-ва р-ров (в частности, на рассеяние света) оказывают флуктуации плотности, концентрации, ориентациимолекул. Роль флуктуации концентрации особенно велика вблизи критич. точки р-римости (см. Критические явления).
Концентрационные зависимости термодинамических функций. Особенностью термодинамич. описания растворов неэлектролитов по сравнению с чистыми компонентами является наличие дополнит. термодинамич. степеней свободы системы, связанных с возможностью изменения состава системы (см. Фаз правило). Число степеней свободы гомогенного n-компонентного р-ра равно n+1. В качестве переменных, определяющих его состояние, наиб. удобно выбрать давление р, т-ру Т и концентрации п — 1 компонентов. Состав растворов неэлектролитов чаще всего выражают через молярные доли компонентов xi, считая независимыми переменными молярные доли всех компонентов, кроме n-го x1,..., xn-1. Для задания концентрации используют и др. шкалы (молярности с,моляльности т).
При описании концентрац. зависимостей термодинамич. ф-ций важную роль играют парциальные молярные величины Mi для i-го компонента, определяемые соотношением:
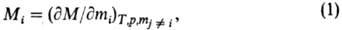
где М-любая экстенсивная термодинамич. ф-ция (объем V, внутр. энергия U, энтальпия H, энтропия S, энергии Гельм-гольца и Гиббса F и G, теплоемкость Ср и т.д.), mi-число молей. Важнейшая парциальная молярная величина -химический потенциал i (парциальная молярная энергия Гиббса); именно через хим. потенциалы формулируются условия хим. и фазового равновесий в системе.
Концентрац. зависимость термодинамич. св-в растворов неэлектролитов нередко характеризуют функциями смешения Мт - изменением термодинамич. ф-ции М при образовании р-ра из чистых жидкостей. Рассматривают смешение при изотермо-изобар-ных (Т, р = const) или изотермо-изохорных (Т, V = const) условиях, причем наиб. практич. интерес представляет случай Т, р — const. Молярная ф-циясмешения при этих условиях (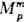 ) определена соотношением:
) определена соотношением:
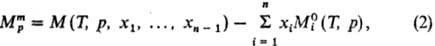
где 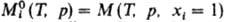 -молярное значение ф-ции M для чистой жидкости i при заданных Т и р. В частности, молярнаяэнергия Гиббса смешения
-молярное значение ф-ции M для чистой жидкости i при заданных Т и р. В частности, молярнаяэнергия Гиббса смешения
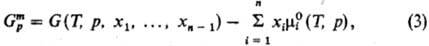
где 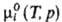 -хим. потенциал чистой жидкости i при заданных Т и р. Для чистых жидкостей
-хим. потенциал чистой жидкости i при заданных Т и р. Для чистых жидкостей 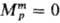 (рис., а). Поскольку образование р-ра при смешении жидкостей - самопроизвольный процесс, то Gm < 0.
(рис., а). Поскольку образование р-ра при смешении жидкостей - самопроизвольный процесс, то Gm < 0.
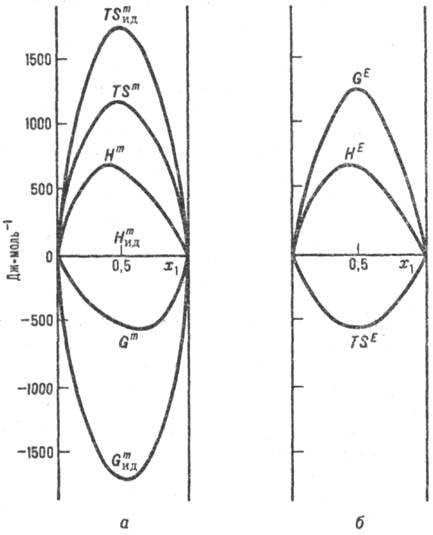
Функции смешения для реального и идеального р-ров (а) и избыточные термо-динамич. функции (б). Система пропанол - циклогексан, 298,5 К; x1-молярная доля пропанола.
Парциальная молярная ф-ция смешения имеет вид:
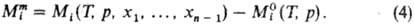
Термодинамич. соотношения, связывающие величины 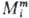 и Мm между собой и с др. термодинамич. параметрами, аналогичны соотношениям, связывающим Mi и М. Так,
и Мm между собой и с др. термодинамич. параметрами, аналогичны соотношениям, связывающим Mi и М. Так,
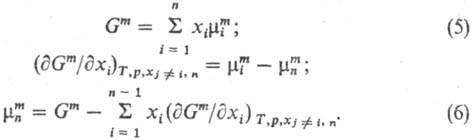
Зависимости энергии смешения Гиббса и хим. потенциалов смешения от т-ры и давления выражаются соотношениями:
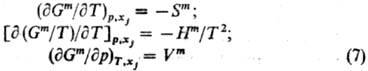
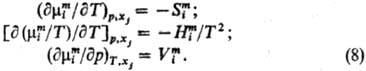
Вдали от критич.точки равновесия жидкость-пар влияние давления на ф-ции смешения жидкого р-ра, как правило, незначительно и им нередко пренебрегают.
Идеальные растворы. Имеется неск. по существу идентичных определений идеального р-ра. Согласно одному из наиб. удобных, это р-р, хим. потенциалы компонентов к-рого во всей областиконцентраций отвечают ур-нию:
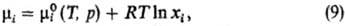
где 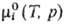 -хим. потенциал чистой жидкости i при тех же давлении и т-ре, что и рассматриваемый р-р, R-газовая постоянная. Ф-циисмешения идеального р-ра:
-хим. потенциал чистой жидкости i при тех же давлении и т-ре, что и рассматриваемый р-р, R-газовая постоянная. Ф-циисмешения идеального р-ра:
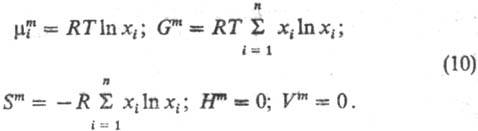
При образовании идеального р-ра энергетич. изменений не происходит, изменяются только энтропия системы и энтропийные составляющие термодинамич. ф-ций.
Если р-р идеальный, а равновесный с ним пар ведет себя как идеальный газ, выполняется Рауля закон:

где pi-парциальное давление i-го компонента над р-ром, 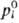 -давление насыщ. пара чистой жидкости при рассматриваемой т-ре.
-давление насыщ. пара чистой жидкости при рассматриваемой т-ре.
Идеальный р-р-гипотетич. система, компоненты к-рой одинаковы по характеристикам межмол. взаимодействий. Так, для бинарного р-ра одинаковыми должны быть потенциалы парного взаимод. компонентов 1 и 2 u11, и22 и u12 (форма потенциалов м. б. любой; в частности, не исключается возможность специфич. взаимод. компонентов 1-1, 2-2 и 1-2 одинаковой интенсивности). При выполнении указанного требования смешение жидкостей не сопровождается энергетич. изменениями. Т.к. число разл. конфигураций в результатесмешения увеличивается в  раз (Ni- число частиц i-го сорта, N = Ni), то энтропия смешения
раз (Ni- число частиц i-го сорта, N = Ni), то энтропия смешения 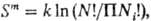 где k-постоянная Больцмана; получаем ф-лы (10).
где k-постоянная Больцмана; получаем ф-лы (10).
Поведение, близкое к идеальному, обнаруживают р-ры, образованные молекулами разл. изотопного состава (напр., С6Н12 и C6D12), оптич. изомерами, соседними гомологами с большой длиной цепи (напр., алканами С25 и С26) и т.д.
Бесконечно разбавленные растворы неэлектролитов. Р-р наз. бесконечно разбавленным по компоненту i, если xi:0. Для определенности будем говорить о бинарном р-ре 1-2 при х2:0 (1-р-ри-тель, 2-растворенное в-во). Особенность такого р-ра состоит в том, что молекулырастворенного в-ва окружены лишь молекулами р-рителя; взаимод. между молекулами растворенного в-ва (типа 2-2)отсутствуют, существенны лишь взаимод. типа 1-1 и 1-2. Пока р-р остается бесконечно разбавленным и взаимод. 2-2 не проявляются, добавляемыемолекулы 2 попадают в среднем в одинаковые условия взаимод. с окружением и каждая дополнительно вносимая молекула дает такой же вклад в среднюю энергию системы, объем и др. св-ва, как и предыдущие. Парциальные молярные энергетич. характеристики р-ра остаются неизменными, и концентрац. зависимость хим. потенциалов компонентов определяется чисто энтропийным вкладом RTlnxi, как и в случае идеального р-ра. Т. обр., при x2:0
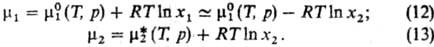
Здесь 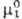 -хим. потенциал чистого р-рителя. Стандартный хим. потенциал
-хим. потенциал чистого р-рителя. Стандартный хим. потенциал 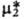 относится к гицотетич. чистой жидкости 2, в к-рой компонент 2 обладает теми же парциальными молярными энергетич. св-вами, что и в бесконечно разб. р-ре.
относится к гицотетич. чистой жидкости 2, в к-рой компонент 2 обладает теми же парциальными молярными энергетич. св-вами, что и в бесконечно разб. р-ре.
При х2: 0 2: —,; S2:,; предельные значения парциальных внутр. энергии, энтальпии, объема растворенного в-ва конечны.
Для бесконечно разб. р-ров выполняется ряд простых количеств. закономерностей, к-рые получили назв. законов разб. р-ров. Это закон Рауля (11) для р-рителя и Генри закон для растворенного в-ва р2 = Кгх2, где р2 - парциальное давление пара растворенного в-ва, x2-его молярная доля в р-ре, Кг - постоянная Генри; закон Вант-Гоффа для осмо-тич. давления = RTc, где -осмотич. давление, с-молярнаяконцентрация растворенного в-ва (см. Осмос); закономерности понижения т-ры замерзания р-ров и повышения т-ры их кипения, если растворенное в-во нелетуче. Для данного р-рителя при фиксированных Т и р давление пара, осмотич. давление, т-ры кипения и замерзания р-ра оказываются зависящими только от концентрации растворенного в-ва, но не от его природы, что объединяет названные св-ва в общее понятие коллигативных.
Важной характеристикой бесконечно разб. р-ров являются функции сольватации-изменения термодинамич. ф-ций (энергии, энтальпии, стандартной парциальной энтропии, стандартного хим. потенциала и др.) при переносе растворенного в-ва из идеальной газовой фазы в бесконечно разб. р-р. Ф-ции сольватации несут количеств. информацию об интенсивности взаимод. молекул растворенного в-ва с р-ри-телем.
 2018-01-21
2018-01-21 1137
1137