Основные понятия химии: атома, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль
Химия – это наука о веществах и законах их превращений.
Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.
Относительная молекулярная масса Мr – это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода – 12. Мr – величина безразмерная. Массу одного моля вещества называют молярной массой (М). Ед.изм. – г/моль.
Относительная атомная масса Аr – это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода – 12.
Если молекулы состоят из одинаковых атомов, то вещество называют – простым.
Если молекула вещества состоит из разных атомов, то вещество называют сложным.
Количества вещества – это число структурных элементов (атомов, ионов, молекул и др.) в системе.
Формула: 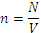
Моль – количество вещества системы, которое содержит столько определенных структурных элементов, сколько атомов содержится в 0,012 кгуглерода - 12.
Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалента одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в ОВР.
Основные законы химии
Основные законы химии:
а) закон сохранения массы: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции;
б) закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам; mA/mB=ЭА/ЭВ
в) закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же количество молекул.
Из закона Авогадро следует 3 вывода:
1) 1 моль любого вещества содержит одинаковое число молекул -NA=6.022*1023(число Авогадро)
2) моли различных газов при одинаковых условиях занимают равные объемы, которые при н.у. (р=760 мм.рт.ст.=1атм. и Т=273,16 К) составляют 22,414 л.;
3) массы различных газов, занимающих одинаковые объемы; относятся м/усобой как их молекулярные массы
m1/m2=М1/М2 при V1=V2
 2018-01-21
2018-01-21 1362
1362