Оцените технологию.
Допустим живем в Сибири зимой.
Берём лист оцинковки и мастерим длинный узкий желоб, расчетной емкостью на 10 литров.
Ждём, когда стукнет - 55 мороза. Выливаем в желоб грязный самогон крепостью 30-40 %.
Даём пару минут на замерзание. Подогреваем этот желоб, до момента плавления самогона, плавно передвигаясь вдоль. 6–8 проходов (столько в полупроводниковых очистителях) и примеси из самогона соберутся с одной стороны.
ЗОННАЯ ПЛАВКА, метод очистки полупроводниковых материалов, таких, как германий и кремний, для применений в микроэлектронике, а других (металлов, химических соединений) – в основном для научных исследований. При использовании этого метода по длинному слитку твердого материала медленно перемещают узкую зону расплава, в результате чего благодаря рекристаллизации происходит перераспределение примесей, растворенных в слитке. Окончательное распределение примесей зависит от их первоначального распределения, числа и ширины зон расплава и направления их движения. Наиболее важное значение имеют два варианта зонной плавки – зонная очистка и зонное выравнивание.
32)Магний. Физические свойства. Получение. Химические свойства Магния. Применение в технике.
1) Химический символ Mg. Расположен в 3 периоде IIА группе ПСЭ. Порядковый номер 12. Электронная конфигурация 12Mg = 1s22s22p63s2. Относительная атомная масса 24,3. 2) Магний ‑ легкий, серебристый металл, на воздухе быстро тускнеет. r = 1,74 г/см3, Тпл =650 ºС, Ткип =1105 ºС. 3) Основной способ получения чистого магния – электролиз расплава смеси солей MgCl2, KClиNaCl. Образующийся металл всплывает на поверхность расплава, откуда его собирают вакуумным ковшом. Дополнительная очистка проводится переплавкой с флюсами – хлоридами или фторидами калия, бария или натрия. Глубокую очистку осуществляют перегонкой в вакууме или зонной плавкой. 4) Магний является очень активным металлом. Во всех своих соединениях проявляет степень окисления +2. В водных растворах существует в виде гидратированного иона Mg2+. Магний легко реагирует практически со всеми неметаллами. С холодной водой магний не реагирует, поскольку покрыт оксидной пленкой. В горячей воде постепенно образует гидроксид  .
.
Реагирует со многими оксидами, вытесняя из них элементы.
Значение стандартного окислительно-восстановительного потенциала 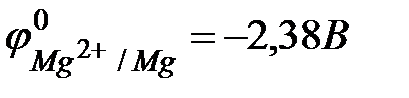 , поэтому магний легко вытесняет водород из растворов кислот
, поэтому магний легко вытесняет водород из растворов кислот 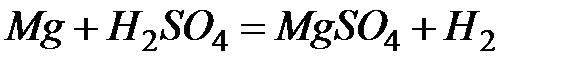 . С основаниями магний не реагирует. В водных растворах способен вытеснять из солей менее активные металлы. 5) Несмотря на высокую химическую активность и низкую температуру плавления и кипения, магний находит широкое применение в технике. Входит в состав ряда сплавов, сообщая им легкость. Широко используется сплав магния с алюминием и марганцем – дюралюминий (основной компонент ‑ Al, около 4 % Cu, 1,5 % Mg и 0,5 % Mn), который называют «авиационным» сплавом. Кроме чистого металла широко используются его соединения. MgCO3·CaCO3 – доломит, применяется для известкования почв. MgO·MgCl2 – используют в строительном производстве (магнезиальный цемент). Наличие ионов
. С основаниями магний не реагирует. В водных растворах способен вытеснять из солей менее активные металлы. 5) Несмотря на высокую химическую активность и низкую температуру плавления и кипения, магний находит широкое применение в технике. Входит в состав ряда сплавов, сообщая им легкость. Широко используется сплав магния с алюминием и марганцем – дюралюминий (основной компонент ‑ Al, около 4 % Cu, 1,5 % Mg и 0,5 % Mn), который называют «авиационным» сплавом. Кроме чистого металла широко используются его соединения. MgCO3·CaCO3 – доломит, применяется для известкования почв. MgO·MgCl2 – используют в строительном производстве (магнезиальный цемент). Наличие ионов  в воде обуславливает ее жесткость. Поэтому, если в технологических процессах используют чистую воду, то от ионов
в воде обуславливает ее жесткость. Поэтому, если в технологических процессах используют чистую воду, то от ионов  необходимо избавляться. Жесткость воды устраняют добавлением извести Ca(OH)2, карбоната натрия Na2CO3, кипячением или ионообменным способом. 6) Магний широко распространен в природе. Содержание в земной коре оценивается в 2,1 %. Mg биогенный.
необходимо избавляться. Жесткость воды устраняют добавлением извести Ca(OH)2, карбоната натрия Na2CO3, кипячением или ионообменным способом. 6) Магний широко распространен в природе. Содержание в земной коре оценивается в 2,1 %. Mg биогенный.
33) Алюминий. Физические свойства. Получение. Химические свойства алюминия. Применение в технике.
1) Химический символ Al. Расположен в 3 периоде IIIа группе ПСЭ. Порядковый номер 13. Электронная конфигурация 13Al = 1s22s22p63s23p1. Относительная атомная масса 27.
2) Алюминий ‑ легкий, серебристый блестящий металл. r = 2,7 г/см3, Тпл =660 ºС, Ткип =2520 ºС. На воздухе очень быстро тускнеет за счет окисления. Обладает высокой электропроводностью, уступая только элементам Ia подгруппы ПСЭ – меди, серебру и золоту.
3) Основным способом получения алюминия является электролиз расплава Al2O3 в криолите Na3[AlF6] с угольным анодом.
Объединяя все процессы, можно записать  .
.
По мере выгорания угольных анодов, они постепенно опускаются в расплав. Очистка алюминия осуществляется вакуумной переплавкой или продувкой хлором при высокой температуре.
4. Алюминий ‑ очень активный металл. Устойчивая степень окисления +3.
Алюминий активно реагирует со многими неметаллами
Алюминий – один из самых оксофильных элементов, образует очень прочное соединение с кислородом. Поэтому алюминий реагирует со многими оксидами с выделением свободного металла.
Значение стандартного окислительно-восстановительного потенциала в водном растворе  , поэтому алюминий активно реагирует с водой и разбавленными кислотами.
, поэтому алюминий активно реагирует с водой и разбавленными кислотами.
С концентрированной серной и азотной кислотой при комнатной температуре алюминий не реагирует – пассивируется.
Алюминий проявляет типичные амфотерные свойства, поэтому реагирует с основаниями, при этом так же выделяется водород.
Реакция со щелочью протекает активнее, чем с кислотами.
Аналогично магнию, алюминий способен вытеснять менее активные металлы из растворов из солей.
34) Титан. Физические свойства. Получение. Химические свойства титана. Применение в технике.
1.Химический символ Ti, расположен в IVb подгруппе 4-м периоде ПСЭ. Порядковый номер 22. Электронная конфигурация 22Ti = Is22s22p63s23p63d24s2. Валентными электронами являются 3d и 4з-электроны. Относительная атомная масса 47,9. 2.В твердом состоянии имеет гексагональную кристаллическую решетку. 3.Титан достаточно легкий, серебристый металл, р = 4,5 г/см3. Физические свойства титана сильно зависят от незначительного количества примесей неметаллов - С, О, S, N, Si, P. Содержащий примеси титан хрупок, чистый титан достаточно пластичен. Тпл =1670 °С, Ткип =3260С. 4. Титан, содержащийся в рудах, переводят в ТiO2, который обрабатывают коксом и хлором при 600 - 800 °С. Далее титан из TiCl выделяют металлотермически действием магния при нагревании 5.Титан достаточно устойчив при комнатной температуре к окислителям, однако при повышенной температуре способен реагировать с ними Ti + О2 = TiO2; Ti + 2Cl2 =TiС14 С водородом не взаимодействует, однако Н2 способен растворяться в титане. Полученный раствор обладает непостоянным составом и электрической проводимостью. При обычных условиях титан с водой не реагирует. При высокой температуре протекает реакция с водяным паром. При нагревании реагирует с соляной кислотой 2Ti + 6HCl = 2TiCl3+3H2. При действии концентрированных серной и азотной кислот пассивируется, но при нагревании реагирует с серной кислотой. Сульфат титанила -  . В водном растворе эта соль распадается. Одно из самых прочных известных соединений TiO2 имеет атомную кристаллическую решетку, обладает высокой химической инертностью, служит источником для получения чистого титана. Проявляет амфотерные свойства. Кроме устойчивой степени окисления +4 известны степени окисления +2 и +3. Соединения титана в низших степенях окисления проявляют сильные восстановительные свойства. 6. Титан из всех металлов обладает самой высокой удельной прочностью. Благодаря этому титановые сплавы широко используют практически во всех отраслях машиностроения. Наряду с алюминием титан является «крылатым» металлом. Титановые сплавы обладают высокой стойкостью к коррозии, могут работать в агрессивных средах и к тому же почти в два раза легче, чем нержавеющая сталь. Новой областью применения титана является изготовление имплантантов органов для человека. Оказалось, что титан обладает биологической совместимостью с человеческими тканями.
. В водном растворе эта соль распадается. Одно из самых прочных известных соединений TiO2 имеет атомную кристаллическую решетку, обладает высокой химической инертностью, служит источником для получения чистого титана. Проявляет амфотерные свойства. Кроме устойчивой степени окисления +4 известны степени окисления +2 и +3. Соединения титана в низших степенях окисления проявляют сильные восстановительные свойства. 6. Титан из всех металлов обладает самой высокой удельной прочностью. Благодаря этому титановые сплавы широко используют практически во всех отраслях машиностроения. Наряду с алюминием титан является «крылатым» металлом. Титановые сплавы обладают высокой стойкостью к коррозии, могут работать в агрессивных средах и к тому же почти в два раза легче, чем нержавеющая сталь. Новой областью применения титана является изготовление имплантантов органов для человека. Оказалось, что титан обладает биологической совместимостью с человеческими тканями.
Кроме металлического титана широко применяют TiO2 - компонент белой краски. В органическом синтезе  используется для получения титанорганических соединений. 7. Малорастворимые соединения титана и сам металл нетоксичны.
используется для получения титанорганических соединений. 7. Малорастворимые соединения титана и сам металл нетоксичны.
35) Хром. Физические свойства. Получение. Химические свойства хрома. Применение в технике.
1. Химический символ Сг. Расположен в VI группе 4-м периоде ПСЭ. Порядковый номер 24. Электронная конфигурация 24Сг = Is22s22p63s23p63d54s1. Валентными электронами являются 3d и 4з-электроны. Относительная атомная масса 52. 2. В твердом состоянии имеет объемно-центрированную кубическую решетку. 3. Тяжелый металл, р = 7,19 г/см3. Тпл = 1890 °С, Ткип = 2680 °С. Хром является самым твердым металлом. С небольшими примесями неметаллов хром очень хрупкий металл, его можно разбить молотком. Чистый хром достаточно пластичен. 4. Из основной массы хромовой руды хром не выделяют, а получают сплав железа и хрома – феррохром. Чистый хром получают следующим образом: 4FeCrO4 + 4Na2СОъ +  2Fe2O3 + 8NaCrO2 + 4СО2. Далее твердый сплав обрабатывают водой. Затем осаждают Сr(
2Fe2O3 + 8NaCrO2 + 4СО2. Далее твердый сплав обрабатывают водой. Затем осаждают Сr( , прокалывают его, и оксид нагревают с алюминием Использовать кокс для получения хрома нельзя, т.к. хром образует ряд прочных карбидов. 5. В своих соединениях хром способен проявлять степени окисления +2, +3, +4, +6, из них наиболее устойчивы +3 и +6. Хром является достаточно активным металлом, способен реагировать со многими неметаллами При взаимодействии с углеродом образует ряд карбидов, по твердости приближающихся к корунду. При нагревании реагирует с водяным паром с образованием оксида хрома (III) Реагирует с разбавленными кислотами Концентрированной серной и азотной кислотой хром пассивируется. В водных растворах способен вытеснять из растворов солей менее активные металлы. Хром и его соединения в степени окисления +3 проявляют ярко выраженные амфотерные свойства. Соединения хрома в степени окисления +6 проявляют кислотные свойства. 6. Хром является одним из важнейших металлов, применяемых для легирования стали. Добавление хрома к стали повышает ее твердость и жаропрочность. Основная масса получаемого хрома расходуется на легирование стали. Сплав хрома с никелем - нихром - обладает высоким электрическим сопротивлением и применяется для изготовления нитей накаливания, нагревательных элементов. Хром используется в термопарах. Термопары служат для измерения высоких температур. Хром используется для декоративно-защитных покрытий металлов. 7. Все растворимые соединения хрома являются токсичными веществами, особенно содержащие хром (VI).
, прокалывают его, и оксид нагревают с алюминием Использовать кокс для получения хрома нельзя, т.к. хром образует ряд прочных карбидов. 5. В своих соединениях хром способен проявлять степени окисления +2, +3, +4, +6, из них наиболее устойчивы +3 и +6. Хром является достаточно активным металлом, способен реагировать со многими неметаллами При взаимодействии с углеродом образует ряд карбидов, по твердости приближающихся к корунду. При нагревании реагирует с водяным паром с образованием оксида хрома (III) Реагирует с разбавленными кислотами Концентрированной серной и азотной кислотой хром пассивируется. В водных растворах способен вытеснять из растворов солей менее активные металлы. Хром и его соединения в степени окисления +3 проявляют ярко выраженные амфотерные свойства. Соединения хрома в степени окисления +6 проявляют кислотные свойства. 6. Хром является одним из важнейших металлов, применяемых для легирования стали. Добавление хрома к стали повышает ее твердость и жаропрочность. Основная масса получаемого хрома расходуется на легирование стали. Сплав хрома с никелем - нихром - обладает высоким электрическим сопротивлением и применяется для изготовления нитей накаливания, нагревательных элементов. Хром используется в термопарах. Термопары служат для измерения высоких температур. Хром используется для декоративно-защитных покрытий металлов. 7. Все растворимые соединения хрома являются токсичными веществами, особенно содержащие хром (VI).
36) Молибден, вольфрам. Физические свойства. Получение.
Химические свойства Молибдена и вольфрама. Применение в технике.
1. Химический символ Мо. Расположен в VIb группе 5-м периоде ПСЭ. Порядковый номер 42. Электронная конфигурация 42М0 = Is22s22p63s23p63dio4p64d54f°5s1. Относительная атомная масса 96.
Вольфрам. Химический символ W. Расположен в VIb группе 6-м периоде ПСЭ. Порядковый номер 74. Электронная конфигурация 74W = 1s22s22p63s23p63d104s24d104f445s25p65d46s2. Относительная атомная масса 183,8. 2. В твердом состоянии Мо и W имеют объемно-центрированную кубическую решетку. 3. Молибден и вольфрам являются тяжелыми металлами. Для молибдена р = 10,2 г/см3, ТПЛ = 2617 °С, Тк - 4612 °С. Для вольфрама р = 19,3 г/см3, ТПЛ = 3410 °С, ТК = 5660 °С. Вольфрам - самый тугоплавкий металл. 4. Основным способом получения Мо и W является пирометаллургия. Минералы W и Мо подвергают обжигу, переводя их в оксиды  и
и 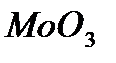 . Чистые металлы получают из оксидов восстановлением водородом. 5. Эти металлы при низкой температуре проявляют низкую химическую активность. Возможны степени окисления +2, +3, +5, +6, причем наиболее устойчивой степенью окисления является +6. Низкие степени окисления стабилизируются за счет образования химических связей М-М, поэтому валентность не совпадает со степенью окисления. В степени окисления +6 Мо и W проявляют кислотные свойства и входят в состав анионов кислот. При низкой температуре Мо и W достаточно инертны, но при высокой они активно взаимодействуют с галогенами и кислородом. При взаимодействии с углеродом и азотом образуют ковалентные карбиды и нитриды, обладающие высокой твердостью w+c=wc. Молибден и вольфрам не реагируют с обычными кислотами, но способны растворяться в смесях кислот. При сплавлении со щелочами и окислителями легко образуются соли кислот. 6. Основное применение находят металлы, а не их соединения. Областью использования является легирование стали. На это расходуется более 90 % производимого вольфрама и молибдена. Помимо повышенной жаростойкости молибденовые стали обладают уникальной способностью сохранять эксплуатационные характеристики при низких температурах. Карбиды и нитриды Мо и W обладают очень высокой твердостью, поэтому они используются для производства металлообрабатывающих инструментов. Сплав используется для изготовления наконечников для сверл. Из сплавов Мо и W изготавливают также высокотвердые резцы для металлорежущих станков.
. Чистые металлы получают из оксидов восстановлением водородом. 5. Эти металлы при низкой температуре проявляют низкую химическую активность. Возможны степени окисления +2, +3, +5, +6, причем наиболее устойчивой степенью окисления является +6. Низкие степени окисления стабилизируются за счет образования химических связей М-М, поэтому валентность не совпадает со степенью окисления. В степени окисления +6 Мо и W проявляют кислотные свойства и входят в состав анионов кислот. При низкой температуре Мо и W достаточно инертны, но при высокой они активно взаимодействуют с галогенами и кислородом. При взаимодействии с углеродом и азотом образуют ковалентные карбиды и нитриды, обладающие высокой твердостью w+c=wc. Молибден и вольфрам не реагируют с обычными кислотами, но способны растворяться в смесях кислот. При сплавлении со щелочами и окислителями легко образуются соли кислот. 6. Основное применение находят металлы, а не их соединения. Областью использования является легирование стали. На это расходуется более 90 % производимого вольфрама и молибдена. Помимо повышенной жаростойкости молибденовые стали обладают уникальной способностью сохранять эксплуатационные характеристики при низких температурах. Карбиды и нитриды Мо и W обладают очень высокой твердостью, поэтому они используются для производства металлообрабатывающих инструментов. Сплав используется для изготовления наконечников для сверл. Из сплавов Мо и W изготавливают также высокотвердые резцы для металлорежущих станков.
37) Марганец. Физические свойства. Получение. Химические свойства марганца. Применение в технике.
1. Химический символ Мп. Расположен в Vllb группе 4-м периоде ПСЭ. Порядковый номер 25. Электронная конфигурация  = 1s22s22p63s23p63d54s2. Относительная атомная масса 55. 2. Низкотемпературная модификация имеет очень сложную кристаллическую решетку, состоящую из 56 атомов. 3. Блестящий металл, р = 7,43 г/см, ТПЛ = 1244 °С, Тк = 2061 °С. Чистый металл достаточно ковкий и пластичный. 4. Основной способ получения - пирометаштургический. Минералами марганца являются пиролюзит МпО2, родохрозит МпСО3. Получают его, восстанавливая МпОг или Мn3О4 углем или СО при высокой температуре. Особо чистый металл получают электролизом раствора MnSO4. 5. Марганец проявляет достаточно высокую химическую активность. Энергично реагирует со многими неметаллами. При обычных условиях не реагирует с водой, но порошок марганца при нагревании взаимодействует с водой с образованием гидроксида. Легко взаимодействует с разбавленными кислотами. Со щелочами реагирует только при нагревании в присутствии сильных окислителей. 6. В технике и промышленности широко используются как свободный металл, так и его соединения.
= 1s22s22p63s23p63d54s2. Относительная атомная масса 55. 2. Низкотемпературная модификация имеет очень сложную кристаллическую решетку, состоящую из 56 атомов. 3. Блестящий металл, р = 7,43 г/см, ТПЛ = 1244 °С, Тк = 2061 °С. Чистый металл достаточно ковкий и пластичный. 4. Основной способ получения - пирометаштургический. Минералами марганца являются пиролюзит МпО2, родохрозит МпСО3. Получают его, восстанавливая МпОг или Мn3О4 углем или СО при высокой температуре. Особо чистый металл получают электролизом раствора MnSO4. 5. Марганец проявляет достаточно высокую химическую активность. Энергично реагирует со многими неметаллами. При обычных условиях не реагирует с водой, но порошок марганца при нагревании взаимодействует с водой с образованием гидроксида. Легко взаимодействует с разбавленными кислотами. Со щелочами реагирует только при нагревании в присутствии сильных окислителей. 6. В технике и промышленности широко используются как свободный металл, так и его соединения.
Применение металла. Марганец является одним из важнейших компонентов сплавов железа. Марганцевые стали обладают повышенной прочностью и твердостью одновременно, что встречается очень редко. Марганцевые стали обладают также высокой ударопрочностью и низкой шумностью, поэтому их используют для изготовления рельсов. Недостатком сплавов из марганца и железа является их низкая устойчивость коррозии. Марганец входит в состав дюралюминия. Пиролюзит МпО2 является сильным окислителем, его используют в лабораторной практике. Является основной рудой марганца. Пиролюзит -катализатор некоторых процессов, а также используется в химических источниках тока. Перманганат калия КМпО4 - «марганцовка» - является одним из сильнейших окислителей. Широко используется в лабораторной практике и для химического анализа некоторых металлов, применяется и как дезинфицирующее средство.
7. Марганец необходим для нормальной жизнедеятельности организма, но в высоких концентрациях токсичен. Особо токсичны соединения марганца (VI) и (VII).
38) Железо. Физические свойства. Получение. Химические свойства железа. Применение в технике.
1)Химический символ Fe. Расположен в VIII b группе 4-ом периоде ПСЭ. Порядковый номер 26. Электронная конфигурация 26Fe = 1s22s22p63s23p63d64s2. Относительная атомная масса 55,85. 2) Плотность 7,86 г/см3 , Тпл 1535°С, Тк 2861°С. Железо обладает магнитными свойствами. При температуре 773 °С магнитные свойства исчезают. Магнитными свойствами обладают также сплавы железа и некоторые его соединения – ферриты, например Fe3O4 – магнетит, CoFe2O4 – феррит кобальта. 3) Основным методом получения Fe является пирометаллургический. При этом все природные соединения переводят в оксиды, которые восстанавливают при высокой температуре коксом, СО, водородом или водяным газом. метод получения железа: Вначале сульфиды железа обжигают и получают оксид железа (III) Оксид железа (III) далее смешивают с избытком кокса и нагревают в доменных печах. Протекает реакция. В домне восстановление протекает не сразу, а с образованием ряда промежуточных соединений, в которых понижение степени окисления железа протекает постепенно. Избыток углерода растворяется в железе. При застывании расплава образуется чугун – сплав железа с содержанием углерода более 2 %. Эти примеси придают чугуну высокую хрупкость и твердость. Для получения высокочистых Fe используют карбонильный цикл. 4) Fe – металлы средней химической активности.. Для железа известны степени окисления +2, +3, +6, +8, из которых наиболее устойчивы +2, +3. Fe легко реагируют с галогенами, серой, кислородом, углеродом. Железо с углеродом образует ряд соединений, важнейшим из которых является FeC3 – цементит, обладающий очень высокой твердостью. Металлы семейства железа не взаимодействуют с водой при комнатной температуре. Однако в присутствии растворенного кислорода железо в воде подвергается коррозии. Гидроксид железа постепенно теряет воду
FeOOH – упрощенный состав ржавчины. Легко реагирует с разбавленными кислотами с образованием солей Э(II). Со щелочами и их растворами при обычных условиях не взаимодействуют. При действии на Fe концентрированной серной или азотной кислоты наблюдается пассивация. 5) Железо составляют основу черной металлургии. Использование железа, которое служит основой для производства различных сплавов, важнейшим из которых являются чугун и сталь. Из-за высокой пластичности железо не применяют в чистом виде. Для получения сплавов с заданными свойствами в железо вводят легирующие добавки – металлы, улучшающие отдельные характеристики сплавов. Проявляют каталитические свойства. Железо – катализатор синтеза аммиака из азота и водорода, кобальт – эффективный катализатор многих реакций, например при получении синтетического бензина из СО и Н2. широко используют соединения:
FeCl3 – хлорное железо, применяется в электротехнике для протравливания медных плат.
FeCl3 является катализатором многих органических реакций.
6) Железо является микроэлементами, и в малых количествах необходимы для нормального функционирования организмов. Железо входит в состав гемоглобина.
39) Кобальт, никель. Физические свойства. Получение. Химические свойства. Применение в технике.
1)Кобальт. Химический символ Co. Расположен в VIIIb группе 4-ом периоде ПСЭ. Порядковый номер 27. Электронная конфигурация 27Co = 1s22s22p63s23p63d74s2. Относительная атомная масса 58,9.
Никель. Химический символ Ni. Расположен в VIIIb группе 4-ом периоде ПСЭ. Порядковый номер 28. Электронная конфигурация 28Ni = 1s22s22p63s23p63d84s2. Относительная атомная масса 58,7.
2) Co- ρ 8,9г/см3, Тпл 1495°С, Тк 2927°С. Ni- ρ 8,9г/см3, Тпл 1455°С, Тк 2900°С 3)Для получения высокочистых Co и Ni используют карбонильный цикл, т.к. карбонилы этих металлов легколетучи и имеют низкие температуры разложения. 4) Co и Ni – металлы средней химической активности., 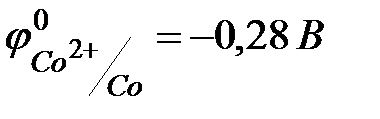 ,
, 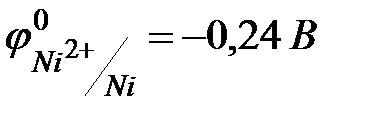 . Для кобальта и никеля известны по две степени окисления ‑ +2, +3, при чем наиболее устойчивой является степень окисления +2. Эти металлы легко реагируют с галогенами, серой, кислородом, углеродом. Все металлы относительно легко реагирует с разбавленными кислотами с образованием солей Э(II). Со щелочами и их растворами при обычных условиях не взаимодействуют. При действии на Co, Ni концентрированной серной или азотной кислоты наблюдается пассивация.5) кобальт, никель составляют основу черной металлургии. Никель – катализатор гидрирования. Используется для гидрирования растительных жиров в маргарин. Железо – катализатор синтеза аммиака из азота и водорода, кобальт – эффективный катализатор многих реакций. Никель используют для нанесения декоративно-защитных покрытий. Никелевые покрытия обладают высокой твердостью, красивым блеском.Соли кобальта и никеля применяют в производстве цветных стекол. Соединения никеля окрашивают стекло в зеленый, а кобальта ‑ в синий цвет. Безводный СоСl2 используется как индикатор в дегидраторах – устройствах для осушки газов.6) кобальт, никель являются микроэлементами, и в малых количествах необходимы для нормального функционирования организмов. кобальт – Входит в состав цитохромов и витамина В12 ‑ кобаламина.
. Для кобальта и никеля известны по две степени окисления ‑ +2, +3, при чем наиболее устойчивой является степень окисления +2. Эти металлы легко реагируют с галогенами, серой, кислородом, углеродом. Все металлы относительно легко реагирует с разбавленными кислотами с образованием солей Э(II). Со щелочами и их растворами при обычных условиях не взаимодействуют. При действии на Co, Ni концентрированной серной или азотной кислоты наблюдается пассивация.5) кобальт, никель составляют основу черной металлургии. Никель – катализатор гидрирования. Используется для гидрирования растительных жиров в маргарин. Железо – катализатор синтеза аммиака из азота и водорода, кобальт – эффективный катализатор многих реакций. Никель используют для нанесения декоративно-защитных покрытий. Никелевые покрытия обладают высокой твердостью, красивым блеском.Соли кобальта и никеля применяют в производстве цветных стекол. Соединения никеля окрашивают стекло в зеленый, а кобальта ‑ в синий цвет. Безводный СоСl2 используется как индикатор в дегидраторах – устройствах для осушки газов.6) кобальт, никель являются микроэлементами, и в малых количествах необходимы для нормального функционирования организмов. кобальт – Входит в состав цитохромов и витамина В12 ‑ кобаламина.
40) Медь. Физические свойства. Получение. Химические свойства. Применение в технике.
1. Химический символ Сu. Порядковый номер 29. Расположена в Ib группе 4-м периоде ПСЭ. Электронная конфигурация 29Cu = Is22s22p63s23p63d104sl. Относительная атомная масса 63,54. 2.В твердом состоянии имеет кубическую гранецентрйрованную решетку. 3. Блестящий металл с красным отливом. Обладает высокой пластичностью и электропроводностью, р = 8,96 г/ смг, Т пл=1083 °С, Тк =2570 °С. 4. Основным методом получения является пирометаллургический Основные минералы меди - сульфиды. Поэтому процесс получения меди состоит из обжига и последующего восстановления оксида меди. Для очистки меди используют электрохимическое рафинирование. Медь является малоактивным металлом. Порошок меди реагирует с галогенами и серой, медленно - с кислородом. При повышении температуры скорость реакции увеличивается. 5. Медь в своих соединениях проявляет степень окисления +1 и +2. При обычных условиях более устойчива +2, при высокой температуре +1. Медь не реагирует с разбавленными кислотами-неокислителями с выделением водорода. При нагревании медь может реагировать с концентрированной серной кислотой Легко реагирует с азотной кислотой. Со щелочами медь не реагирует. Соединения меди (II) являются достаточно сильными окислителями. 6. Медь - один из первых металлов, которые начало использовать человечество. Из-за своей мягкости чистая медь мало используется. Гораздо шире применяются различные сплавы меди. Бронза - сплав меди с оловом. Латунь - сплав меди с цинком. Благодаря высокой электропроводности медь применяется в электротехнике для изготовления проводников, электродов. Сплав меди, никеля и серебра - мельхиор - используют для изготовления посуды. Из сплава меди с никелем чеканят монеты. Медный купорос применяется как средство для борьбы с вредителями растений. Медь содержащие соли используют для изготовления цветных стекол. 7. Медь - очень токсичный металл. Обладает свойством накапливаться в организме. Особо опасны растворимые соли меди - CuSO4, CuCl2, Cu(NO3)2. Загрязнение медью рек и озер осуществляется главным образом предприятиями, на которых используют гальванические ванны и медьсодержащие элементы.
41) цинк. Физические свойства. Получение. Химические свойства. Применение в технике. 1. Химический символ Zn. Расположен в Па группе 4-м периоде ПСЭ. Порядковый номер 30. Электронная конфигурация 3oZn = 1s22s22p63s23p63dio4s2. Относительная атомная масса 65,37. 2. В твердом состоянии имеет гексагональную решетку. 3. Цинк - блестящий серебристо-белый металл, р = 7,13 г/см3, Тпл = 420 °С, Тк = 960 °С. Обладает достаточно высокой электро- и теплопроводностью.
4. Основными минералами цинка являются ZnS — сфалерит или вюрцит, ванимнит Zn2Si04. Основной способ получения - гидрометаллургический или пирометаллургический. Вначале цинксодержащие минералы обрабатывают H2SO4, а затем из ZnSO4 чистый металл получают электролитически. При пирометаллургическом получении сульфид подвергается обжигу, а остаток восстанавливают оксидом углерода (II). Получение высокочистого цинка проводят путем вакуумной перегонки или электропшаковым переплавом с флюсами. 5. Цинк - достаточно активный металл. Во всех соединениях цинк находится в степени окисления +2. Активно реагирует со многими неметаллами. При обычных условиях с водой не реагирует. Как свободный металл, так и его оксид и гидроксид проявляют ярко выраженные амфотерные свойства с преобладанием основных. И металл, и его соединения способны легко растворяться и в разбавленных кислотах, и в растворах щелочей. Благодаря высокой химической активности цинк применяется для вытеснения менее активных металлов из растворов их солей, например, золота или серебра из цианидных комплексов по методу Багратиона, рассмотренному ранее. 6. Металлический цинк находит широкое применение. Важной областью его применения является получение сплавов с медью - латуней. Большое количество цинка расходуется для защиты железа от коррозии. Применение цинка для изготовления «сухих» гальванических элементов. Соединения цинка находят меньшее применение. ZnO в качестве краски - цинковые белила. В качестве одного из компонентов для приготовления люминофоров - составов, светящихся в темноте, применяют ZnS.
7. Соединения цинка токсичны, хотя в небольших количествах он содержится в организме и выполняет важную биологическую функцию. По причине токсичности соединений металла оцинкованная посуда не должна применяться для приготовления пищи.
42) Сплавы. Интерметаллические соединения. Сплавы металлов с неметаллами.
Сплав — макроскопически однородная смесь двух или большего числа химических элементов с преобладанием металлических компонентов. Основной или единственной фазой сплава, как правило, является твёрдый раствор легирующих элементов в металле, являющемся основой сплава.
Сплавы имеют металлические свойства, например: металлический блеск, высокие электропроводность и теплопроводность. Иногда компонентами сплава могут быть не только химические элементы, но и химические соединения, обладающие металлическими свойствами. Например, основными компонентами твёрдых сплавов являются карбиды вольфрама или титана. Макроскопические свойства сплавов всегда отличаются от свойств их компонентов, а макроскопическая однородность многофазных (гетерогенных) сплавов достигается за счёт равномерного распределения примесных фаз в металлической матрице.
Сплавы обычно получают с помощью смешивания компонентов в расплавленном состоянии с последующим охлаждением. При высоких температурах плавления компонентов, сплавы производятся смешиванием порошков металлов с последующим спеканием (так получаются, например, многие вольфрамовые сплавы).
Сплавы являются одним из основных конструкционных материалов. Среди них наибольшее значение имеют сплавы на основе железа и алюминия. В состав многих сплавов могут вводиться и неметаллы, такие как углерод, кремний, бор и др. В технике применяется более 5 тыс. сплавов.
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Некоторые из них имеют полупроводниковые свойства.
Некоторые из металлов могут реагировать друг с другом очень активно. Например, реакция цинка и никеля при температурах выше 1000 °C носит взрывной характер.
44) Коррозия. Коррозия в растворах неэлектролитов. Ингибиторы коррозии.
Коррозией называется самопроизвольный процесс разрушения металлов под действием факторов окружающей среды, сопровождающийся выделением энергии и рассеиванием вещества. Металлы играют важную роль в народном хозяйстве. Коррозия ежегодно разрушает до 10 % производимого железа в мире. Поэтому важным моментом при изучении свойств конструкционных материалов является рассмотрение вопросов устойчивости различных металлов, а также приемов защиты металлов от коррозии.К химической коррозии относят также коррозию в неводных растворителях, например в хлорированных и бромированных углеводородах. Так, свинец при высокой температуре способен реагировать с хлорсодержащими органическими соединениями по схеме:  PbCl2 является достаточно летучим и удаляется с поверхности металла.
PbCl2 является достаточно летучим и удаляется с поверхности металла.
Разновидностью химической коррозии является газовая коррозия. Некоторые металлы, такие как металлы VIIIb подгруппы периодической системы элементов способны растворять в себе некоторое количество водорода. При этом водород переходит в атомарное состояние. Образовавшиеся атомы водорода проникают в межатомное пространство металла и образуют твердые растворы внедрения.
45) Газовая коррозия. Электрохимическая коррозия.
Разновидностью химической коррозии является газовая коррозия. Некоторые металлы способны растворять в себе некоторое количество водорода. При этом водород переходит в атомарное состояние. Образовавшиеся атомы водорода проникают в межатомное пространство металла и образуют твердые растворы внедрения. Атом водорода имеет маленький радиус, поэтому процесс протекает достаточно легко, однако при большом содержании водорода становится заметным его влияние на состояние кристаллической решетки металла. Внедрение большого числа атомов водорода приводит к увеличению расстояния между атомами металла. В результате резко падают пластичность и прочность металла, в то же время резко увеличивается хрупкость. Так, при длительной эксплуатации теплообменников в газообразной среде, содержащей водород, металл настолько насыщается водородом, что стенку толщиной несколько миллиметров можно без особых усилий продавить пальцем. Обычно скорость газовой коррозии невелика.
Электрохимическая коррозия протекает при контакте металла с раствором электролита. 1. При коррозии протекает процесс окисления металла Zn° -2e = Zn+2. При водородной деполяризации электроны переходят к ионам водорода, которые восстанавливаются.
Водородная деполяризация наблюдается в растворах с высокой концентрацией ионов Н+. 2. В нейтральной и слабощелочной среде в качестве деполяризатора уступают молекулы воды 2Н2О + 2е = Н2 + 2ОН. Процесс окисления металла Zn° -2e = Zn+.
46) Способы защиты от коррозии.
1. Пассивная защита металлов. Заключается в изолировании поверхности металла или сплава от внешней среды. Внешнее покрытие должно обладать определенной устойчивостью к коррозионной среде, обладать высокой адгезией к поверхности металла.
Существуют следующие разновидности изолирующих покрытий.
· Защитные органические покрытия. К ним относят защитные краски и лаки. Кроме этих защитных покрытий можно использовать прямое нанесение расплавов или растворов полимеров на металлы. Применяют полиэтиленовые, полиоксиметиленовые, поливинилхлоридные покрытия на металлических трубах, используемых для транспортировки газов и нефтепродуктов. Относительно недавно предложено наносить полимеры методом электрохимически инициируемой полимеризации, при этом полимер связывается с поверхностью металла не за счет межмолекулярных сил, а обычной ковалентной связью, поэтому такое покрытие более прочно соединено с металлом.
· Защитные покрытия из неорганических веществ. В этом варианте проводят химическую модификацию поверхности металла путем обработки различными реагентами.
Широко распространено оксидирование – нанесение на поверхность оксидных слоев. Этот метод применяется для защиты алюминия. Применяют азотирование – насыщение поверхностного слоя азотом. При этом не только возрастает коррозионная устойчивость, но и термическая стабильность сплавов.
Фосфатирование – процесс осаждения малорастворимых фосфатов на поверхности металла.
· Защитные покрытия из металлов. Металлические защитные покрытия делят на две группы – катодные и анодные. Пассивной защитой является катодное покрытие. В этом случае на защищаемый металл наносится слой металла, имеющего более положительное значение стандартного окислительно-восстановительного потенциала. Широко используют хромирование. Помимо низкой химической активности хромовое покрытие обладает декоративными свойствами.
2. Активная защита металлов. Активная защита металлов от коррозии осуществляется металлами с более отрицательными значениями стандартных окислительно-восстановительных потенциалов. Для железа широко используется цинкование – нанесение цинка на поверхность. Поэтому Zn будет являться анодом и разрушаться при контакте с коррозионной средой, а железо будет катодом и до тех пор, пока сохраняется некоторое количество цинка, железо разрушаться не будет. Недостатком применения цинкового покрытия является высокая токсичность ионов Zn2+.
 2018-01-21
2018-01-21 623
623







