Лекція 1.
Бензен
Загальна формула: С6Н6
Відкрив Фарадей у 1825 р. Відкрив будову у 1865 Кокулє.
 Будова:
Будова:
Має єдину 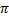 -систему, що
-систему, що
складається з 6 РZ
L=0,140 нм
Кут = 120о
Sp2-гібридизація
Фізичні властивості:
Бензен – безбарвна летка рідина з своєрідним запахом, легша за воду.
t пл. = 5,5оС, t кип. = 80,1оС, молярная масса = 78,11 г/моль.
Погано розчиняється у воді, добре – в органічних розчинниках, розчиняє йод, сірку, білий фосфор.
Хімічні властивості бензену
1. реакції заміщення
• реакція нітрування (якісна реакція)
• реакція сульфування
| -H2 |

• реакція Фриделя-Крафтса

• реакція ацілювання за Фріделем-Крафтсом
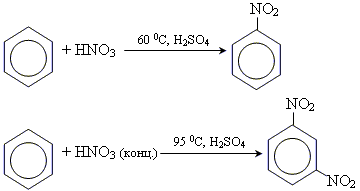
• реакція галогенування (-Cl, -Br)

2. реакції приєднання
3. Реакція горіння сильнокоптящим полум’ям
2С6Н6 +15О2 t 12СО2 + 6Н2О
Добування:
 1. дегідрогенізація циклогексану
1. дегідрогенізація циклогексану
 2.
2.
| Cr2O 500OC |
3. СН3-СН2-СН2-СН2-СН2-СН3 + 4Н2
4. З кам’яновугільної смоли фізичним способом
Застосування:
Хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів і багатьох інших органічних речовин. Часто застосовується як розчинник. Додавання бензену поліпшує якість моторного пального.
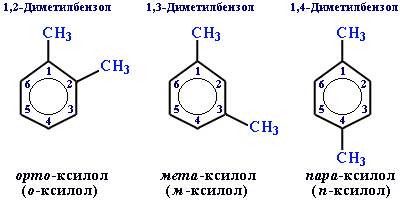
Гомологи бензену:
Загальна формула: СnH2n-6
Лекція 2.
Толуен
Фізичні властивості:
Толуен – прозора рідина, має різкий запах. Температура плавління = 94,99оС, температура кипіння = 110,62оС
1. Реакції заміщення
*реакції заміщення протікають значно легше, ніж у випадку бензену, оскільки метильна група суттєво активує бензольне ядро.
• реакція нітрування

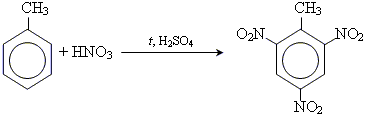
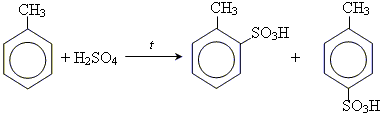
• реакція сульфування
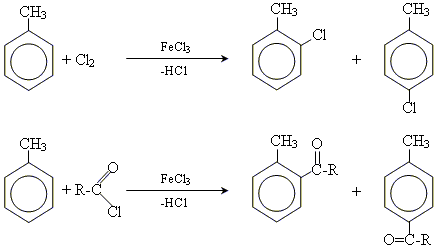
• галогенування за вільнорадикальним механізмом (Cl2 або Br2)
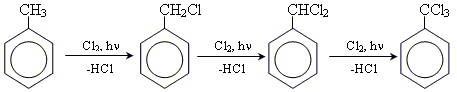
2. Реакції окиснення толуену
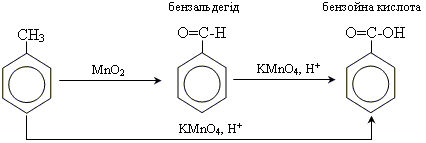
Добування:
1.Толуен можна отримати по реакції Фріделя-Крафтса:
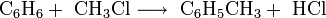
2. Дегідроциклізація гептану

Взаємний вплив атомів у молекулі толуену:
Внаслідок заміщення в молекулі бензену атома Гідрогену на метильну групу –СН3 утворюється толуен. Під впливом замісника у симетричній молекулі бензену порушується рівномірний розподіл електронної густини зв’язків, одні атоми Карбону стають активнішими, інші – пасивнішими в реакціях заміщення. Метильна група подає електронну густину на бензольне ядро, вона збільшується в положеннях 2, 6 та 4, тобто з’являється частковий негативний заряд.
Зі свого боку бензольне ядро також впливає на метильну групу. Щоб виявити це, порівняймо властивості толуену і метану. Як відомо, метан не знебарвлює розчин КMnО4, тобто не окислюється ним. Якщо ж до толуену додати цей розчині суміш нагріти, вона поступово знебарвлюється.
Застосування:
Толуен використовують для синтезу тротилу (2,4,6-тринітротолуолу), бензойної кислоти, сахарину, домішок до моторних палив для підвищення октанового числа.
Механізм реакцій електрофільного заміщення:
| π-комплекс |
| G-комплекс |
 1 стадія
1 стадія
2 стадія
– нестійкий катіон, який не має ароматичної системи, містить 4π-електрони, які розміщені в сфері 5 атомів Карбону. 6 атом Карбону знаходиться у стані Sp3-гібридизації. G-комплекс перетворюється у стабільно заміщений бензен з втраченим протоном.
Вплив бензольного кільця на метильну
групу у тому, що метан стійкий до дії
окисників, але коли 1 атом Н у метані
заміщується на фінілрадикал, то ця сполука
легко окислюється з утворенням бензойної кислоти.
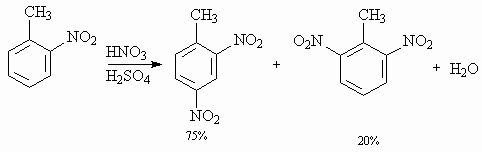
| Вплив метальної групи на бензольне кільце у тому, що толуол легко нітрується в орто та пара положеннях |
Лекція 3.
 2018-01-21
2018-01-21 2205
2205








