Лекція 1.
Аміни
Аміни – похідні аміаку, в молекулі якого, один або декілька атомів гідрогену заміщенні на вуглеводні радикали.
Класифікація:
1) За кількістю атомів Н заміщенних у молекули аміаку. Первинні – 1 атом, вторинні – 2 атоми, третинні – 3 атоми заміщенно.
2) За природою вуглеводневого залишку. Насичені, ненасичені, ароматичні, змішані.
3) За кількістю аміно групп.
Ізомерія
-будова вуглеводневого залишку
-положення аміногрупи
-кількість вуглеводних залишків.
Фізичні властивості
Метиламін, диметиламін, три метиламін – гази, до 15 атомів карбону – рідини, більше – тверді речовини.
Нишчі аміни добре розчиняються у воді, виші – нерозчинні. Анілін – C6H5NH2 найпростіший ароматичний амін – безбарвна рідина із характерним запахом, розчинна у спирті, бензині, малорозчинна у воді.
Аміак – безбарвний газ з різким запахом, удвічі легший за повітря, дуже добре розчиняється у воді.

Будова
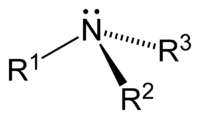
Атом азоту у молекулах амінів має неподілену електронну пару, завдяки чому аміни здатні приєднувати катіони Н+ й виявляти основні властивості. Неподілена пара 2s – електронів атома нітрогена переходить у порожню 1s орбіталь іона гідрогена, зумовлює 4й зв'язок його атома за донорно-акцепторним механізмом. Аміни є органічними основами. Насичені аміни – основи, сильніші за аміак, що зумовлене тим, що насичений вуглеводний замісним зміщує електронну густину в бік атома азота, електронна густина на азоті збільшується, внаслідок чого зростає його здатність до сполучення з катіоном гідрогена
1. Основні властивості амінів
СН3NН2 + H2O = [СН3NН3]OH = [СН3NН3] + + OH-;
СН3NН2 + HCl = [СН3NН3]Cl
Аміни є більш слабкими основами, ніж аміак. Зі збільшенням величини вуглеводневого радикалу основні властивості послаблюються. Ароматичні аміни є більш слабкими основами ніж аліфатичні аміни.
2. Горіння амінів
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Добування
1. отримання за реакцією Гофмана
2NН3 + СН3Br→ СН3NН2 + NН4Br;
СН3NН2 + CН3Br + NН3 → (СН3)2NН + NН4Br;
(СН3)2NН + CН3Br + NН3 → (СН3)3N + NН4Br
2. отримання ароматичних амінів за реакцією Зініна
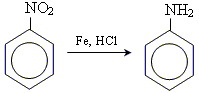
Застосування:
Аміни широко використовуються в анілофарбувальній та хімічно-фармацевтичній промисловості, наприклад, як складники реагентів при флотації та масляній агломерації (грануляції, флокуляції) вугілля.
Лекція 2.
 Анілін
Анілін
Анілін – найпростіший ароматичний амін, що має формулу С6H5NH2
Анілін є основою, слабкішою за аміак і інші аміни. У його молекулі неподілена ел. Пара азота зміщується в бік бензинового кільця й утворює з ним єдину пи – електронну систему.
Фізичні властивості
Анілін – безбарвна рідина із слабких характерним запахом. При окисненні повітрям набуває світло-коричневого забарвлення. Малорозчинна у воді. Дорбе розчиняється в орг. Розчинниках. Дуже отруйний.
Зумовлені наявністю аміногрупи і ароматичного кільця.
§ Реакціїції за участю бензольного кільця
Анілін легше вступає в реакції заміщення, ніж бензен, завдяки взаємодії аміногрупи внаслідок того, що ел. Густина бензинового ядра в молекулі аніліну стає більшою, ніж у бензолі
1)Реакція з бромом

§ Реації за участю аміногрупи
Внаслідок того, що на атомі нітрогену густина зміщенна до бенз. Ядра, атом нітрогені повільніше притягує протон і сладкіше його утримує.
Тому основні властивості виявляються слабкіше, ніж у аміаку і інших амінів, так анілін, на відміну від атомів і аміаку не взаємодіє с водою і не змінює забарвлення індикаторів.
2)Анілін взаємодіє тільки з сильними мінеральними кислотами
C6H5-NH2 + HCl → [C6H5-NH3]+Cl-
3)Реакції ацілювання і алкілування без каталізаторів йдуть до групи NH2.
Якісна реакція
При додаванні хлорного вапна (Ca(ClO)Cl),NaClO до водного розчину аніліну утв. Фіалкове забарвлення, внаслідок окиснення
Добування
Основний спосіб добування аніліну – відновлення нітробензену воднем за температури 250—350оС та наявності каталізатора:
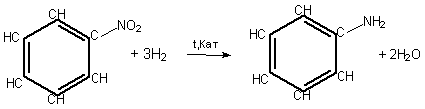
Застосування:
Застосовується як напівпродукт у виробництві барвників, вибухових речовин і лікарських засобів (сульфаніламідні препарати).
Лекція 3.
Амінокислоти
Амінокислоти – похідні карбонових кислот, у молекулах яких 1 або кілька атомів Гідрогену вуглеводневого ланцюга заміщенні на аміногрупи. До складу їх молекул входять одночасно аміногрупа і карбоксильна група. Аміногрупа зумовляє основні властивості, карбоксильна – кислотні властивості, отже амінокислоти є амфотерними.
Класифкація:
§ За природою вуглеводневого ланцюга: насичені, ненасичені, ароматичні
§ За взаємним розміщенням функціональних груп
§ 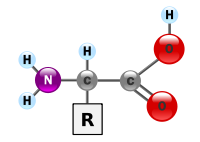 За кількістю функціональних груп в молекулі:амінокислоти, моноамінодикарбонові кислоти, діаміномонокарбонові кислоти.
За кількістю функціональних груп в молекулі:амінокислоти, моноамінодикарбонові кислоти, діаміномонокарбонові кислоти.
Загальна ф-ла
Гомолічний ряд
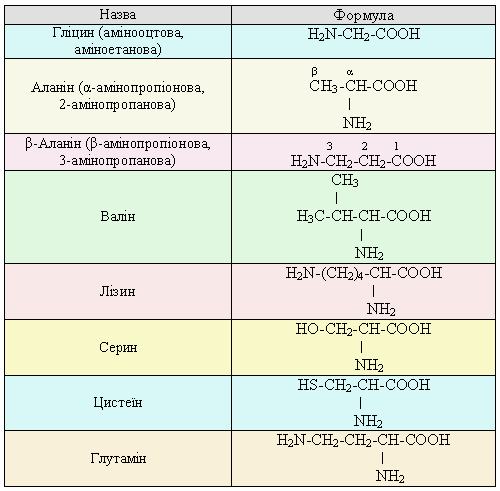
Номенклатура: Назви складають, додаючи префікс аміно- до назв відповідних карбонових кислот. Положення позначають цифрами або грецькими літерами. 1-відповідає атому карбону карбоксильної групи.
Фізичні властивості
Амінокислоти – кристалічні речовини, розчинні у воді й нерозчинні в органічних розчинниках. Деякі мають солодких чи гіркий смак. Температури плавління амінокислот вищі ніж відповідних карбонових кислот.
Це зумовлено тим, що амінокислоти у твердому стані скаладаються не з молекул, а з особливих іонів, що називаються біполярними.
Завдяки цьому розчини амінокислот, у молекулах яких міститься по 1й карбоксильній та аміногрупі, є нейтральними і не діють на індикатори.
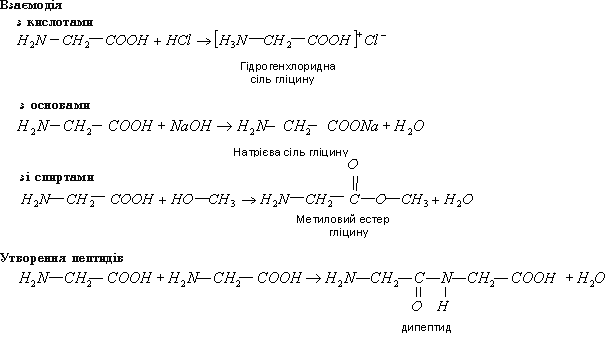 Маючи і кислотні и основні групи, амінокислоти виявляють амфотерні властивості. Це можна довести тим, що вони реагують і з кислотами і з основами:
Маючи і кислотні и основні групи, амінокислоти виявляють амфотерні властивості. Це можна довести тим, що вони реагують і з кислотами і з основами:
Наявність аміногрупи, що має основні властивості і карбоксильної групи, що має кислотні властивості, зумовлює їх внутрішню молекулярну взаємодію (нейтралізацію) і утворення внутрішньо молекулярних солей – біполярних іонів:
Від карбоксильної групи відщеплюється протон, який потім приєднується до аміногрупи цієї самої молекули за місцем неподіленої пари електронів атом Нітрогену. Внаслідок цього дія карбоксильної і аміногруп компенсується і утворюється біполярний іон. Оскільки молекули амінокислот існують у вигляді біполярних іонів, то в разі підвищення концентрації іонів OH- в разчині амінокислоти реагують аміногрупою, яка при цьому віддає протон.
З підвищенням кислотного середовища у розчині амінокислоти реагують карбоксильної групи, яка приєднує протон.
Реакція є оборотною. Протилежне перетворення відбувається у вигляд гідролізу пептиду за наявності сильної кислоти при температурі.
Добування:
1) Гідроліз білків: Відбувається за тривалого нагрівання білків з кислотами та лугами або за звичайної температури під дією ферментів. Продуктами є суміш амінокислот, з якої дуже важко виділити чисту амінокислоту.
2) Мікробіологічний синтез, що відбувається у клітинах мікроорганізмів, чи поза ними під впливом ферментів. Наприклад, із вуглеводнів, що входять до складу нафти добувають глютамінову к-ту.
3) Синтез із галогенокарбонових кислот
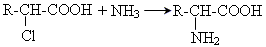
4) Із нітрокислот
5) Гідроліз амінонітрилів
Застосування:
На додаток до синтезу протеїнів, амінокислоти в тваринному організмі виконують багато інших важливих біологічних функцій. Гліцин та глутамат (аніон глутамінової кислоти), окрім входження до складу протеїнів, використовуються також як нейромедіатори при нервовій передачі через хімічні синапси. Велика кількість амінокислот є проміжними продуктами при синтезі інших важливих речовин: так,триптофан є прекурсором нейромедіатору серотоніну, а гліцин є одним з реагентів в синтезі порфірінів (таких як дихальний пігмент гем). Деякі з 20-ти протеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі і повинні надходити з їжею.
| Аминокислота | Формула |
| Глицин |  |
| Аланин | 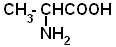 |
| Валин | 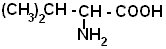 |
| Лейцин | 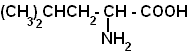 |
| Глутаминова кислота | 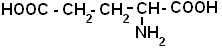 |
| Лизин | 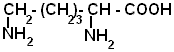 |
| Серин | 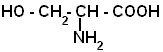 |
| Цистеин |  |
| Аспаргин | 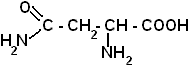 |
| Глутамин |  |
Лекція 4.
Білки
Білки – високомолекулярні органічні сполуки, які складаються з великої кількості сполучених між собою пентидним зв’язком залишків альфа – амінокислот.
Склад:
В усіх білках містяться: Карбон (50-55%), Оксиген (21.5 – 23.5), Нітроген (15-17%), Гідроген (6.5-7.3%), Сульфур (0.3-2.5%), а також невеликі кількості Фосфору, Йоду, Феруму и т.д.
Молекули білків скаладаються із залишків амінокислот.
Відомо понад 20 видів амінокислот, що входять до складу білків. Ії називають протеїногенними.
Класифікація:
Розрізняють прості и складні білки. До простих (Протеїнів) належать ті, молекули яких складаються лише з амінокислот.
Складні (протеїди) містять ще й залишки молекул небілкової природи: вуглеводів, фосфатів, нуклеїнових кислот.
Як утворюються:
Залишки амінокислот у молекулах білків сполучаються між собою за допомогою пентидної групи –CO-NH-. Це було доведено на основі експериментів: під час додавання до лужних розчинів білків і продуктів їх неповного гідролізу розчину сульфату купруму вони забарвлювались у фіолетовий колів, так само, як інші сполуки, що не належали до білків, але містили ту саму групу –CO-NH- (біуретова реакція)
Пентидний зв'язок утворюється внаслідок взаємодії карбоксильної групи однієї молекули амінокислоти з аміногрупою іншої молекули амінокислоти
Внаслідок такої реакції утворюється сполуки – пептиди. Було доведено, що молекули білків побудовані з 1го або кількох поліпептидних ланцюгів.
Структура білків:
Існує 4ри рівні організації білкових молекул:
Первинна структура білка – порядок сполучення залишків амінокислот в поліпептидному ланцюгу.
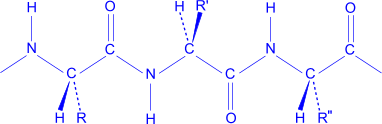
Кожний індивідуальний білок має свою чітко визначену послідовність сполучення залишків амінокислот.
Вторинна структура білка – утворення спіралі із поліпептидного ланцюга за допомогою водневих зв’язків між C=O та N-H.
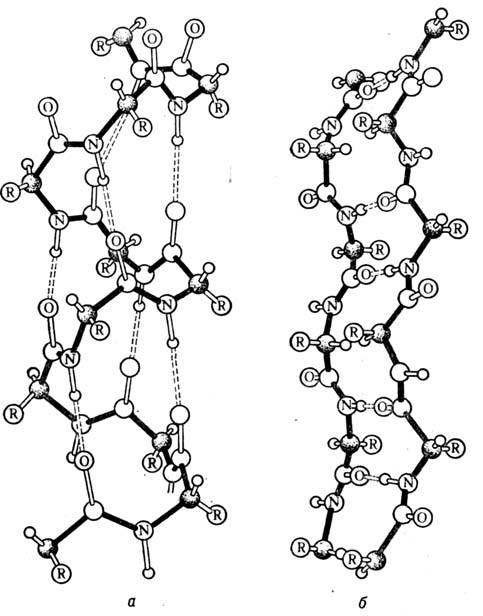
Третинна структура білка – утворюється внаслідок закручення спіралі у клубок (глобулу). У результаті зближення атомів сульфуру утворюється дисульфідні зв’язки, а карбоксі групи і аміногрупи – сольві граються важливу роль у стабілізації 3ї структури.
Четвертинна структура – розміщення у просторі декількох глобул поліпептидних спіралей. Стабілізується за допомогою утворення слабких (не ковалентних) зв’язків.
За формою молекул білки поділяють на фібрилярні та глобулярні. Фібрилярні – мають ниткоподібні молекули, погано розчиняються у воді. Глобулярні – кулеподібна форма молекул, краще розчинні у воді.
Фізичні властивості
Не мають температур плавління та кипіння. При нагріванні темніють і починають розкладатися, поширюючи запах паленого пір’я. Деякі розчиняються у воді утворюючи колоїдні розчини.
Денатурація
Руйнування третинної і третинної структури білків під дією хімічних реагентів, нагрівання або радіації
Гідроліз
Руйнування первинної структури білків під дією хімічних реагентів (луги, кислоти, ферменти) з утворенням a-амінокислот
 2018-01-21
2018-01-21 2664
2664








