Большинство веществ обладают малой растворимостью в воде и других растворителях. В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между твердой фазой и ионами, образующимися при частичном растворении осадка.
Так, в насыщенном растворе электролита АnBm, находящегося в равновесии с его твердой фазой, будет протекать следующий обратимый процесс:
растворение
АnBm (т) ↔ nАm+(р-р) + mBn-(р-р)
осаждение
Этот процесс протекает на поверхности осадка. Состояние этого равновесия по закону действующих масс количественно характеризуется константой, называемой произведением растворимости (ПР):
ПР (AnBm)=[Am+]n ∙ [Bn–]m
В насыщенном растворе малорастворимого электролита произведение молярных концентраций ионов, возведенных в степени, равны их стехиометрическим коэффициентам, есть величина постоянная при данной температуре, и называется произведением растворимости.
ПР – табличная величина. Например, ПР(СаSO4)=2,5∙10-5, ПР(AgCl)=1,8∙10-10. Из двух однотипных солей большей растворимостью обладает та соль, у которой ПР больше – это СаSO4.
CaSO4 ↔ Ca2+ + SO42-
ПР(CaSO4) = [ Ca2+] ∙ [ SO42-]
[ Ca2+] = [ SO42-] = s
ПР(CaSO4) = s2
s = 
PbI2 ↔ Pb2+ + 2I-
ПР(PbI2) = [Pb2+ ] ∙ [ I-]2
[ Pb2+] =s, [ I-] = 2s
ПР(CaSO4) = s ∙ (2s)2 = 4s3
s = 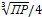
Следовательно, произведение растворимости и растворимость – взаимосвязанные величины, поэтому по известной растворимости вещества можно найти значение произведения растворимости и наоборот.
Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение ПР, т.е. ПС>ПР, то раствор является пересыщенным и из него выпадает осадок. Если ПС<ПР, то осадок растворяется – ненасыщенный раствор. Если ПС=ПР, то система находится в состоянии равновесия – насыщенный раствор.
 2018-01-21
2018-01-21 887
887