Состояние системы, которое характеризуется обычными параметрами состояния называется макросостоянием.
Совокупность мгновенных характеристик каждой из частиц называется микросостоянием.
Термодинамическая вероятность состояния системы (W) – число микросостояний, с помощью которых реализуется данное макросостояние.
Уравнение Больцмана: 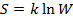 .
.
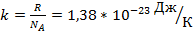 – константа Больцмана.
– константа Больцмана.
Энтропия есть мера неупорядоченности системы.
Второе начало термодинамики: в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, то есть к росту энтропии.
Увеличение энтропии наблюдается при переходе жидкости в пар, при растворении кристаллического вещества.
Если в ходе реакции объем увеличился, то энтропия возрастает и наоборот.
Если объем не изменяется, то энтропия тоже практически не изменяется.
Стандартная молярная энтропия вещества  - энтропия одного моля вещества при стандартных условиях и соответствующей температуре.
- энтропия одного моля вещества при стандартных условиях и соответствующей температуре.
Энтропия относится к термодинамическим функциям состояния системы.
aA+bB=cC+dD
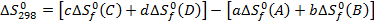
Энтропии простых веществ не равны нулю.
При обратимом процессе: 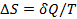
При адиабатном процессе:  , поэтому ∆S=0.
, поэтому ∆S=0.
При изобарном процессе: 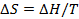 .
.
Энтропия системы возрастает тем сильнее, чем ниже температура, при которой поглощается теплота.
 2018-01-21
2018-01-21 1589
1589








