
∆H – энтальпийный фактор, T∆S – энтропийный фактор.
В условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса.
При низких температурах могут самопроизвольно протекать экзотермические реакции, а при высоких – реакции, сопровождающиеся увеличением энтропии.
Так как температура принимает только положительные значения из уравнений следует, что для самопроизвольной реакции изменение энергии Гиббса должно иметь отрицательное значение. При ∆G<0 реакция термодинамически разрешена и система стремится к ∆G=0, при котором наступает равновесное состояние обратимого процесса. Увеличение энергии Гиббса ∆G>0 свидетельствует о невозможности протекания процесса при данных условиях.
Стандартная энергия Гиббса образования данного соединения – стандартное изменение энергии Гиббса в реакциях образования одного моля соединения из простых веществ в их стандартных состояниях при стандартных условиях. 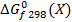
Значения энергий Гиббса образования простых веществ в их стандартных состояниях при стандартных условиях равны нулю.
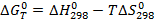
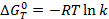 Если
Если 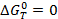 , то k=1.
, то k=1.
· Если Н°Т < 0, S°Т > 0, то G°Т < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
· Если Н°Т > 0, S°Т < 0, то G°Т > 0 всегда (процесс не протекает ни при какой температуре).
· Если Н°Т < 0, S°Т < 0, то G°Т < 0 при Т < Н°/S° (процесс идет при низкой температуре за счет энтальпийного фактора).
· Если Н°Т > 0, S°Т > 0, то G°Т < 0 при Т > Н°/ S° (процесс идет при высокой температуре за счет энтропийного фактора).
 2018-01-21
2018-01-21 2350
2350








