Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству прошедшего через электролит электричества. m(V)=kQ=kIτ
m – масса вещества, г; V – объем вещества, л; k – электрохимический эквивалент, г/Кл(л/Кл); Q – количество электричества, Кл; I – сила тока, А; τ – время, с.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам:  ;
;  .
.
M(Vм) – молярная масса(объем) выделяющегося вещества, г/моль; n – количество электронов, переносимых в электродном процессе; F – число Фарадея (F=96500Кл/моль).
Величина M/nF называется электрохимическим эквивалентом вещества.
Выход по току – отношение массы вещества, реально выделенного на электроде, к теоретическому и умноженное на 100%. 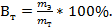
Для случая осаждения массы на электроде выход по току оказывается всегда выше 1. Для случая растворения материала электрода выход по току оказывается всегда ниже 1.
При электролизе всегда выделяется или растворяется меньше вещества, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления практически всегда протекают побочные. Кроме того, часть электрической энергии тратится на преодоление сопротивления электролита, то есть на нагрев электролита и электродов.
 2018-01-21
2018-01-21 843
843








