В 1911 году английский физик резерфорд предложил ядерную (планетарную) модель атома, где атом состоит из положительно-заряженного ядра, а вокруг него вращаются электроны. Сам атом электронейтральный. Вращаются электроны с определенной энергией, которая меняется скачкообразно(дескретно), допустимые уровни энергии электрона определяются значением целого числа N и назвали это число – квантовое число, квант-порция энергии.
Квантовые числа n – определяет энергию электрона и размеры электронных облаков. Электронное облако – траектория движение электрона. Энергия электрона зависит от расстояния электрона от ядра, чем ближе к ядру, тем меньше его энергия. Электрон находится на наиболее удаленном от ядра уровне обладает max энергией, поэтому при переходе электрона с более удаленного на более близкий выделяются порции энергии (кванты).
l – орбитальное квантовое число.
Согласно квантово механическим расчетам электронные облака отличаются не только размерами, но и формой, различная форма электронных облаков обуславливает изменение энергии электронов в предыдущем одного энергетического уровня, если n=1, тоl=0. Таким значением l характер электронного облака, имеющие шаровуюсиметрию. Такие электроны называются s – электронами.
|
|
|
n=2, l=0,1
если l=1, то электроны называются p – электроны
Li 1s22s12p0
n=3, l=0,1,2, электроны называются d - электронами
Электроны, обладающие l=2, называютсяd – электронами.
Магнитное квантовое число ml – характеризует пространственную ориентацию электронных облаков.
ms – спиновое квантовое число.
Электрон, двигаясь в поле ядра атома, обладает собственным магнитным моментом, т.к. сам электрон вращается вокруг собственной оси.
Спиновое число может принимать значению +1/2 и -1/2.
+ и – связана с направлением его вращения, т.к. спин – это величина векторная, то принято электроны всегда обозначать стрелками.
3. Размещение электронов в атомах. Принцип Паули. Правило Хунда Размещение электронов на энергетических уровнях.
Если атом находится не возбужденном состоянии, то его электроны занимают самые низкие по энергиям орбитали.
Принцип Паули (шведский химик). Он вывел в 1925 г принцип запрета – в атоме не может быть 2х электронов, у которых были бы одинаковыми все 4 квантовых числа. Согласно этому принципу на одной орбитали могут находиться только 2 электрона, имеющие 3 одинаковых квантовых числа, но различные спины.
Правило Хунда (Х~В). При заполнении электроном энергетических уровней существует следующая закономерность: на данном уровне электроны стремятся занять энергетический уровень таким образом, чтобы суммарный спин был максимальным.
|
|
|
С 1s22s22p2
4. Периодический закон и периодическая система элементов Д.И. Менделеева (s,p,d – элементы, периоды и группы, электронное строение атомов) Периодическая система элементов.
Исследуя изменения химсв-в элементов в зависимости от величины их относительной массы. Менделеев 1869 г. открыл закон периодичности этих веществ.свойства элементов и потому и свойства образуемых ими простых или сложных тел стоят в периодической зависимости от атомных весов элементов. Физическая основа периодического закона была установлена в 1922 г. Нельеом Бором, в результате он представил классификацию элементов находящихся в таблице с точки зрения числа электронов в нейтральном атоме, которая равна заряду ядра атома. При образовании хим связи, электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому со временем формулировка периодического закона гласит след образом, свойства элементов находящихся в периодической зависимости от зарядов ядер их атомов. Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов.
Период – это горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа, таких периодов 7, второй и последний период начинается щелочным элементом и заканчивается инертным газом. По вертикали периодическая система подразделяется на 8 групп, причем каждая группа делится на главную подгруппу (sи p элементы) и побочную подгруппу (d – элементы). элементы главной подгруппы содержать на внешнем уровне одинаковое число электронов, которое равно номеру группы.
Na (11) 1s22s22p63s13p03d0
Сходство элементов внутри каждой группы наиболее важная закономерность в периодической системе. Все периоды начинаются с щелочных металлов и все периоды заканчиваются инертными газом, путь которых заполнен внешними электронами.
5. Основные свойства атомов (энергия ионизации, электроотрицательность, сродство к электрону, валентность, степень окисления) Все атомы находящиеся в периодической системе было принято характеризовать определенным числом свойств: размер атомов, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления. Все перечисленные свойства связаны с электрической конфигурацией атома. Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов, в расчетах пользуются так называемыми эффективными и кажущимися радиусами. Эти радиусы шарообразных атомов сближенных между собой при образовании кристаллов. Чем больше атомный радиус, тем слабее удерживаются внешние электроны и наоборот. В периоде атомный радиус увеличивается слева направо, а в группе сверху вниз. Энергия ионизации обозначается как (J) – это энергия необходимая для отрыва наиболее слабо связанного электрона от атома, измеряется в электровольтах. Атомы могут не только отдавать, но и присоединять электроны, при этом образуя соответствующий анион. Выделившая при этом процессе энергия называется сродством к электрону (Е) – измеряется так же в электровольтах и наибольшее …… в конце периода.
Электроотрицательность. Определение электроотрицательности (Х) дал в 1932 г знаменитый ученый Полинг – это способность атома в молекуле притягивать к себе электроны. Для количественной характеристики предложено считать меры электроотрицательности энергию, равную арифметической сумме энергии ионизации атома и энергии сродства к электрону (Х=J+Е).самое большое значение имеет фтор (21,4 эл.вольта), а электроотрицательность литий (1 эВ) и сравнивают электроотрицательностью значения других элементов.
6. Химическая связь. Типы химической связи (ковалентная – полярная и неполярная, ионная, металлическая, водородная, межмолекулярная)
|
|
|
Химическая связь.
образование соединения из атомов и ионов кристаллических и аморфных веществ сопровождается уменьшением энергии по сравнению с не взаимно действующими атомами. При этом минимальная энергия соответствует определение расположения атомов друг относительно друга и при этом происходит существенное перераспределение электронной плотности. Силы, удерживающие aтомы в новых образованиях получили обобщенное название химической связи.важнейшие и виды химической связи следующие:
- ковалентная
- ионная
- металлическая
- водородная
Согласно электронной теории валентности химическая связь возникает за счет
за счет перераспределения электронов валентные орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа.
1) насчет образования ионов
2) образование общих электронных пар
Химическая связь характеризуется энергией и длиной.мерой прочности связи служит энергия, затрачиваемая на разрушение связи или выигрыш в энергии при образовании соединения из отдельных атомов.
Есв – энергия связи
длина связи - это расстояние между ядрами в том или ином соединении.
химическая связь обычно изображается черточками соединяющими взаимоотносительные атомы.каждая черточка эквивалентна обобщенный паре электронов. если соединить содержащие больше двух атомов, то важной характеристикой является валентный угол образуемый химическими связями молекул и отражение его геометрически. полярность молекулы определяется разностью электроотрицательности атомов, образующих двух центров связь, геометрических молекул, а также наличием не поделённых электронных пар не участвующих в образовании связи. полярность связи выражается через смешение электронной пары к более электроотрицательному атому и может быть выражено через дополнительный момент. ()
типы хим. связи.
1) Ковалентная связь – это наиболее общий вид химической связи. Возникает за счет обобществления электронной пары посредством двух механизмов:
|
|
|
- обменный механизм, когда каждый из взаимных атомов поставляет по одному электрону.
- донорно-акцепторный, в этом случае у одного атома имеется избыток пары электронов, которые передаются в общее пользование, этот атом называется донором другому атому, у которого имеются свободные или вакантные орбитали и это называется акцептор.
существуют два вида ковалентной связи: неполярная(наблюдается у гомо ядерных молекул); полярная связь (наблюдается у гетеро ядерных молекул, так какэлектроотрицательность атомов таких молекул различные).
2) ионная - это частный случай ковалентной связи и здесь образуется электронная пара полностью принадлежащая более электро отрицательному атому, который становится анионом. Раз этот атом становится анионом.....
соединение с такой связи можно описывать в электростатическом приближении, считая, что ионная связь обусловлена притяжением положительных и отрицательных ионов.
взаимоотношения ионов противоположного знака не зависит от направления, а электростатический силы не обладаютсвойствами насыщаемости.для ионной связи характерно образование кристаллической решетки, тоесть ионом кристалле нет молекул. каждый ион окружен определенным числом ионов другого знака.
3) металлическая связь возникает результате частичной делаколизации валентных электронов, которые свободно движутся решетки металлов.при этом они взаимодействуют с положительно заряженными ионами металла, находящимся в узлах решетки.
4) водородная связь.образование такого вида связи обусловлена тем, что результате сильного смещение электронной пары электроотрицательному атому, атом водорода обладает эффективным положительным зарядом может легко взаимодействовать другим электро отрицательным атомом.
5) межмолекулярная химическая связь осуществляется между молекулами за счет бан-дер-вальсевых сил, тоесть слабые электростатические силы.
7. Три основных свойства ковалентной связи 1)кроме поляризуемости ковалентная связь обладает свойством насыщаемости, то есть это способность атома образовывать столько ковалентных связей сколько у него имеется энергетический доступных атомных орбиталей.
3) свойства-направленность. ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей реагирующих атомов.
2) свойство – поляризуемость.
8. Образование π- и σ- связей (показать графически)
Алгебраическая сумма и линейная комбинация 2-х S-орбиталей
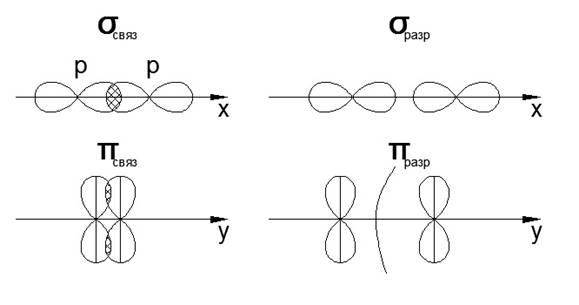
Алгебраическая сумма и линейная комбинация 2-х P-орбиталей
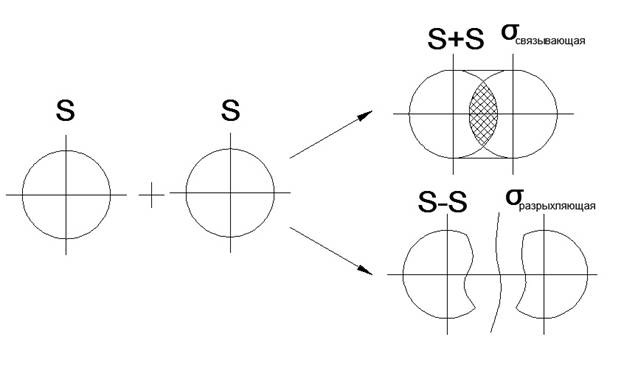
Распределение электронов по молекулярным орбиталям происходит в соответствии с принципом «минимум энергии», т.е. электронами заполняются орбитали, которые имеют минимум энергии и которые являются очень прочными (связывающие орбитали)
Переход электронов на молекулярные орбитали всегда способствует повышению энергии, и этот энергетический выигрыш равен энергии связи между атомами в молекуле
9. Метод молекулярных орбиталей.
ММО позволяет представить как происходит распределение электронов по молекулярным орбиталям.
В основе этого метода лежит представление о том, что все электроны данной молекулы или иона распределены по соответствующим молекулярным орбиталям. Описать молекулы по теории молекулярных орбиталей – это значит определить ее орбитали, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии. Распределение электронов происходит в соответствии с принципом Паули и правилом Хунда, все молекулярные орбитали представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей.
 2018-01-21
2018-01-21 499
499






