Энергетический уровень – совокупность всех орбиталей с одним и тем же значением n. Число уровней, на котором находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент: 1, 2, 3 …
Энергетический подуровень – совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначаются: s, p, d, f …
I энергетический уровень – 1 подуровень
II энергетический уровень – 2 подуровеня
III энергетический уровень – 3 подуровеня
Орбиталь – область пространства, наиболее вероятного пребывания электрона в электр. Поле ядра атома. Орбитали характеризуются квантовыми числами.
Типы орбиталей:
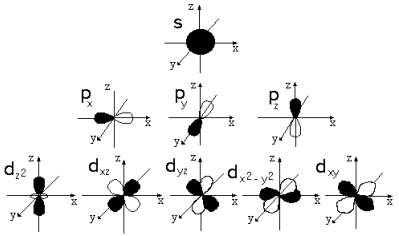
Принцип Паули и следствие из него:
В атоме не может быть 2-х электронов, которые бы имели одинаковый набор всех 4-х квантовых чисел.
Следствием этого принципа является тот факт, что в атоме последовательно заполняются все орбитали.
Принцип наименьшей энергии:
Принцип определяет последовательность заполнения орбиталей электронами, в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Основное состояние – это наиболее устойчивое состояние атома, в котором электроны занимают орбитали с наименьшей энергией.
Правило Гунда:
В основном состоянии атом имеет максимально возможное число неспаренных электронов в пределах определенного подуровня. Например, если на 2p-подуровне находятся три электрона. То они должны находиться на 3-х разных орбиталях:
 |  |  |
В этом случае суммарный спин максимален и равен 3/2.
Электронные формулы (конфигурации) атомов:
Электронная конфигурация – формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Для легких орбиталей любой период начинается с s-орбитали, а заканчивается p-орбиталью (кроме 1-го). Если присутствуют несколько тяжелых орбиталей, то сначала заполняется та, чья pi меньшая.
Последовательность заполнения орбиталей электронами определяется принципом наименьшей энергии: в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
1s <2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p
Nхар = ni + li
БИЛЕТ
Периодический закон химических элементов и его физический смысл:
Периодический закон, сформированный Менделеевым в 1869г., звучит следующим образом:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Таким образом, изменение свойств химических элементов по мере возрастания их атомной массы не совершается непрерывно в одном и том же направлении, а имеет периодический характер.
Физический смысл периодического закона состоит в том, что при последовательном возрастании зарядов ядер главного квантового числа, периодически повторяется сходные валентные электронные структуры атомов, и как следствие, периодически повторяются химические свойства элементов
Периодическая система элементов:
Периодическая система элементов – классификация химических элементов, графически изображаемая в виде периодической таблицы. Она состоит из семи периодов (десяти рядом) и восьми групп.
В этой системе Менделеев разделил все элементы на периоды и расположил один период под другим так, чтобы сходные по свойствам и типу образуемых соединений элементы приходились друг под другом.
 2018-01-21
2018-01-21 11433
11433








