Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
§ 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
|
|
|
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:


Уравнение константы равновесия для данной реакции будет иметь вид:
 или
или 
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных  можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:

Численное значение константы гидролиза получим, используя ионное произведение воды  и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты 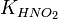 :
:


подставим в уравнение константы гидролиза равна:

В общем случае для соли, образованной слабой кислотой и сильным основанием:
 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
|
|
|
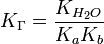
Буферное действие – основной механизм протолитического гомеостаза в организме. Механизм действия буферных систем. Зона буферного действия и буферная ёмкость. Расчёт рН буферных систем.
Буферные системы – это растворы, обладающие способностью сохранять постоянство рН среды при разбавлении, а также при добавлении небольших количеств сильной кислоты или щелочи.
рН венозной крови 7,36
артериальной – 7,4
Буферная система состоит из донора протонов (кислоты) и акцептора (сопряжённого основания).
Наиболее распространены:
1. Слабая кислота и соль этой кислоты и сильного основания (ацетатный, гидрокарбонатный, цитратный – это с лимонной кислотой)
2. Кислая и средняя соли слабой многоосновной кислоты (фосфатный)
3. Две кислые соли слабой многоосновной кислоты (фосфатный)
4. Слабое основание и соль этого основания и сильной кислоты (аммиачный)
5. Ионы и молекулы амфолитов (белки и аминокислоты)
рН буферной смеси зависит только от соотношения компонентов и не зависит от концентрации. Протоны добавленной кислоты будут связываться с основанием, а гидроксид-анионы добавленного основания – с кислотой буф. Смеси. Предел действия ограничен количеством компонентов буферной смеси. Мерой буферного действия количественно характеризующей способность буферных систем противодействовать смещению активной реакции среды – буферная ёмкость.
Буферная ёмкость равна числу молей эквивалента сильной кислоты или сильного основания, которое нужно добавить к 1 л буф. Смеси, чтобы его рН изменился на 1.
Буф. Ёмкость зависит от:
Концентраций компонентов раствора.
Соотношения концентраций. Чем соотношение ближе к 1, тем больше ёмкость.
Вопрос
Бу́ферные систе́мы кро́ви (от англ. buffer, buff — смягчать удар) — физиологические системы и механизмы, обеспечивающие кислотно-основное равновесие в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов.
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (NaH2P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с NaH2P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера.
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Эта буферная система также способствует предупреждению сдвига рН крови
|
|
|
Важнейший показатель гомеостаза организма — концентрация ионов водорода (H+) в клетках, плазме и других внеклеточных средах. Содержание Н+ в последних влияет на конформацию макромолекул, физико-химическое и структурное состояние мембран, интенсивность образования активных форм кислорода и гидроперекисей, возбудимость, лабильность и проводимость возбудимых тканей, особенно нервных структур, чувствительность рецепторов к ФАВ, гормонам, медиаторам, сродство Нb к кислороду, активность ферментативных реакций и т.д.
Количество ионов Н+ в биологических средах организма определяет их кислотно-основное состояние (КОС), или кислотно-щелочное равновесие (КЩР), или реакцию крови. Величина КОС зависит от содержания в крови кислот, оснований и буферных систем. Интегральным показателем КОС считают величину рН, являющуюся отрицательным десятичным логарифмом молярной концентрации ионов водорода в биологической среде (например, в крови). То есть рН = -log [Н4]. Чем больше концентрация Н+ в биологической среде, тем меньше величина рН, и наоборот — чем ниже концентрация Н+ в биологической среде, тем выше величина рН.
Вопрос
Константа равновесия — Константа равновесия величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов  и
и  , рассчитанное по формуле (44), больше, чем произведение растворимости
, рассчитанное по формуле (44), больше, чем произведение растворимости  при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.  (44)
(44)
Если возникает необходимость растворить осадок  , то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения
, то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения
|
|
|
Обр костной ткани
10Ca(OH)2 + 6H3PO4 = Ca10(PO4)6(OH)2 + 18H2O
3Ca3(PO4)2 + Ca(OH)2 = 2Ca5(PO4)3OH
5CaHPO4 + 6NaOH = Ca5(PO4)3OH + 2Na3PO4 + 5H2O
 2018-01-21
2018-01-21 27286
27286