Осмос - одностороняя диффузия через полупроницаемую мембрану (проникновение воды в сахарозе)
Давление, которое нужно приложить к раствору, чтобы прекратился осмос называетсяосматическим.
Растворы с одинаковым осматрическим давлением, наз. изотермическими.
Пар находящийся в равновесии с жидкостью наз. Насыщенным и жидкость закипает тогда, когда давление насыщенного пары становится равным атмосферному.
Температура кипения и замерзания зависит от давления насыщенного пара
Закон Вант-Гоффа:
Осматическим давлением раствора не электролита пропорционально концентрации растворённого вещества и абсолютной температуре.
Pi=CRT
1-ый Закон Раулся:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества:
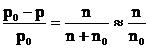
 ,
,  -растворителя
-растворителя
Ой закон Рауля
Повышение температуры кипения и понижение температуры замерзания раствора неэлектролита пропорциональны молярной концентрации растворённого вещества.


Где Э и К –эбумиоскопическая и криоскопическая постоянные, Э и К зависят от природы растворителя.
 2018-01-21
2018-01-21 742
742








