В гетерогенных системах, содержащих заряженные частицы, на границе раздела фаз неизбежно возникает разность электрических потенциалов. Например, при погружении металлической пластинки в воду (или в раствор соли данного металла) наблюдается обмен ионами между твердой и жидкой фазами. При этом на границе раздела металл - раствор в результате протекания реакции
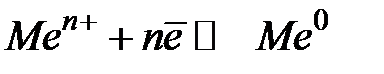
|
образуется двойной электрический слой (ДЭС) и возникает скачок потенциала, называемый электродным потенциалом.
Измерить абсолютное значение электродного потенциала невозможно. Задача практического определения электродного потенциала была решена путем использования условной шкалы, в которой потенциалы исследуемых электродов сопоставляют с потенциалом электрода сравнения. В качестве такого электрода сравнения был выбран стандартный водородный электрод, электродный потенциал которого условно принят за нуль. Согласно правилам ИЮПАК электродным потенциалом считается электродвижущая сила (ЭДС) элемента, в котором слева расположен стандартный водородный электрод, а справа - исследуемый электрод. Электродный потенциал обозначается также как и ЭДС, т. е. буквой Е.
|
|
|
Количественная зависимость между величиной электродного потенциала (Е, В) и активностью ионов данного металла ( 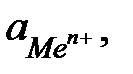 моль/л) выражается уравнением Нернста:
моль/л) выражается уравнением Нернста:
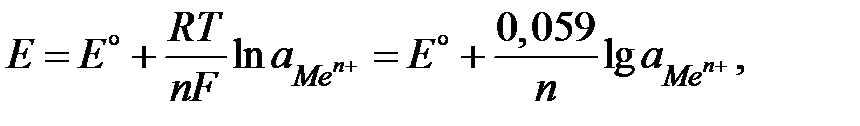
| (4.11) |
где E º - стандартный (нормальный) электродный потенциал, В; R – универсальная газовая постоянная, 8,314 Дж/(моль∙К); Т – температура, К; n - валентность ионов данного металла; F - число Фарадея, 96 500 Кл/моль.
Стандартным электродным потенциалом (E º) называется потенциал электрода при активности ионов данного металла, равной 1 моль/л. Потенциалы электродов измеряют по отношению к стандартному водородному электроду.
Стандартный водородный электрод представляет собой платиновую пластинку с развитой поверхностью, погруженную в раствор кислоты при активности ионов H+ в растворе равной единице, и контактирующих с газообразным водородом, давление которого равно 1,01325 · 105 Па (1 атм).
Различают электроды первого и второго рода. В электродах первого рода восстановленной формой является металл электрода, а окисленной формой – ионы этого металла. Как правило, электроды первого рода обратимы либо относительно катиона, либо - аниона (т. е. их потенциал является функцией активности либо только катиона, либо только аниона). К электродам первого рода относятся медный ( 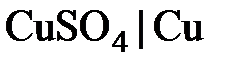 ), цинковый (
), цинковый ( 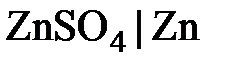 ), хлорный (
), хлорный (  ), кислородный (
), кислородный ( 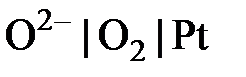 ) и др.
) и др.
Электродами второго рода могут служить системы, в которых металл электрода покрыт труднорастворимой солью этого металла и опущен в раствор, содержащий хорошо растворимый электролит с одноименным анионом. Окисленной формой в таких электродах является труднорастворимая соль, а восстановленной – металл и анион соли. Электроды второго рода обратимы как относительно катиона, так и аниона (т. е. их потенциал является функцией активности как катиона, так и аниона). Примерами электродов второго рода являются каломельный ( 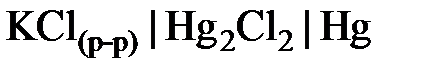 ), хлоридсеребряный (
), хлоридсеребряный ( 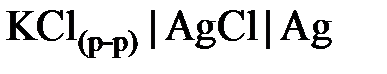 ).
).
|
|
|
Существуют также электроды, которые не обмениваются с растворами ни катионами, ни анионами, а только обеспечивают подвод и отвод электронов для окислительно-восстановительной реакции, протекающей в растворе. Они называются окислительно-восстановительными (или редокс-электродами) и представляют собой пластинку из инертного металла (например, платиновую), опущенную в раствор, содержащий окисленную и восстановленную формы какого-либо вещества. Например, 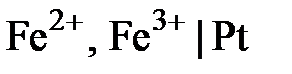 .
.
Электроды, имеющие устойчивый потенциал и используемые для определения потенциалов других электродов, называются электродами сравнения. К ним относятся водородный ( 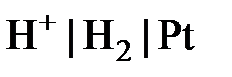 ), каломельный, хлоридсеребряный.
), каломельный, хлоридсеребряный.
Следует особо выделить электроды потенциал которых зависит от активности ионов водорода в растворе, т. е. от pH раствора:
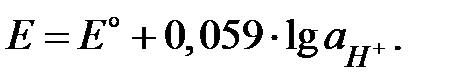
| (4.12) |
Такие электроды называют индикаторными. Широкое применение в качестве индикаторных электродов получили водородный, стеклянный, хингидронный ( 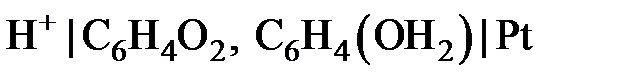 ) электроды, которые используются для определения pH различных биологических жидкостей, почвенных растворов, молочных и других пищевых продуктов.
) электроды, которые используются для определения pH различных биологических жидкостей, почвенных растворов, молочных и других пищевых продуктов.
Электрохимические цепи – системы, состоящие из двух электродов, помещенных в раствор электролита или в два разных раствора, находящихся в контакте друг с другом. Электрохимические цепи, способные вырабатывать электрическую энергию за счет энергии изменения функции Гиббса химической реакции, называют гальваническими элементами.
Различают химические и концентрационные гальванические элементы (или цепи). Примером химического гальванического элемента может служить элемент Якоби - Даниэля, состоящий из медного и цинкового электродов, погруженных в растворы своих растворимых солей. Для гальванического элемента принята следующая форма записи:
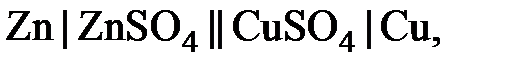
|
где одинарная сплошная вертикальная линия обозначает границу раздела между разными фазами (металл – раствор), а двойная вертикальная линия – границу между двумя жидкими фазами (растворами солей) при отсутствии диффузионного потенциала.
При замыкании электродов во внешней цепи слева направо движутся электроны, а в растворе - ионы. Это означает, что на левом электроде идет процесс окисления, а на правом - восстановления. Суммарное уравнение реакции, протекающей при работе данного элемента, имеет вид
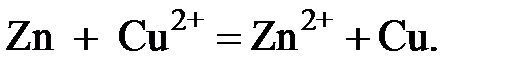
|
Вследствие неодинаковой подвижности ионов электролита на границе раздела двух жидких фаз возникает разность потенциалов, называемая диффузионным потенциалом. Для его устранения между растворами солей помещают электролитический (солевой) мостик с электролитом, подвижности ионов которого близки (например,  ).
).
Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется электродвижущей силой (ЭДС, E) элемента (цепи). Величина ЭДС элемента равна разности значений потенциалов положительного (правого) и отрицательного (левого) электродов. При этом значение E будет всегда положительным. Для элемента Якоби-Даниэля ЭДС вычисляют по формуле:

| (4.13) |
где 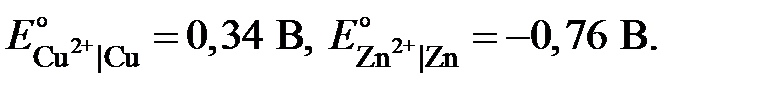
Таким образом, работа химических гальванических элементов происходит за счет процессов окисления – восстановления, протекающих раздельно на каждом электроде. Комбинируя различныеокислительно-восстановительные полуреакции, можно получить большое число гальванических элементов.
|
|
|
В концентрационных элементах электрическая энергия образуется за счет выравнивания концентраций растворов. Для изготовления концентрационного элемента пластинки из одного и того же металла погружают в растворы его соли различной концентрации.
Например,
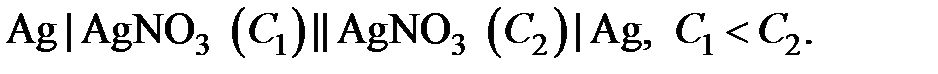
|
ЭДС концентрационного элемента можно вычислить по формуле

| (4.14) |
 2018-01-21
2018-01-21 3265
3265








