Влияние изменения условий приизменения концентрации. Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево — в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество (Н2), увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию — его концентрация пони-зиласьТаким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества. При изменении давления. При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т. е. в сторонy понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления ,При изменении температуры. При повышении температуры равновесие смещается в направлении эндотермической, а при понижении — в направлении экзотермической реакции. Практическая ценность принципа Ле-Шателье -Брауна состоит в том, что он позволяет без конкретного анализа предсказывать направление, в котором будут изменяться термодинамические характеристики равновесной системы, подвергшейся внешнему воздействию.Этот принцип оказался удобен для выяснения, в каком направлении смещается состояние равновесия сложной, многокомпонентной системы в случаях, когда детальный анализ затруднителен. Особенно полезным этот принцип оказался в применении к химическим реакциям. Так, если химическая реакция эндотермическая, то есть протекает с поглощением теплоты, то нагревание системы ведет к возрастанию выхода продуктов реакции, и наоборот, если реакция экзотермическая (с выделением теплоты), то нагревание системы ведет к уменьшению выхода продуктов реакции. Понятно, что знание такого поведения химических реакций чрезвычайно полезно для практики, так как позволяет в зависимости от потребности усилить или уменьшить эффект внешнего воздействия.
|
|
|
27.Катализ и катализаторы. Гомогенный и гетерогенный катализ. Автокатализ. Механизм ионного катализа согласно теории промежуточных соединений. Катализатором называется вещество, которое изменяет скорость реакции, но само в ходе процесса не расходуется. Небольшое количество катализатора может изменять скорость превращения больших количеств реагирующих веществ. Катализ может быть положительным и отрицательным. Положительные катализаторы ускоряют реакции. Роль положительного катализатора состоит в том, что он изменяет механизм реакции, открывает новый путь протекания реакции, при котором ниже энергия активации. В результате увеличивается доля активных молекул и константа скорости реакции. Отрицательные катализаторы, называемые ингибиторами, препятствуют обычному пути протекания реакии, связывая промежуточные вещества и тем самым затрудняют протекание многостадийной реакции, замедляют ее.Независимо от типа катализатора и химизма процесса катализаторам свойственны следующие особенности:1. Катализатор никак не меняет стехиометрическое уравнение реакции.2. Катализатор в равной степени изменяет скорости прямой и обратной реакции, т.е. изменяет скорость достижения равновесия. Это означает, что с помощью катализатора невозможно сместить равновесие.Для объяснения механизма катализа С.Аррениус высказал предположение, что катализаторы образуют с реагирующими веществами нестойкие промежуточные соединения. Предположим, что реакция А + В АВ протекает медленно, а вещество К является катализатором. Согласно теории промежуточных соединений реакция состоит из двух стадий:А + К АК (быстро),АК + В АВ + К (быстро),суммарно А + В АВ (быстро)Таким образом, катализатор принимает участие в реакции: на одной стадии он расходуется, а на другой регенерируется.Все катализаторы можно разделить на три группы: гомогенные, гетерогенные и биологические (ферменты).При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. Гомогенный катализ может быть в газовой фазе и в растворе. Примером первого типа процессов может служить каталитическое окисление сернистого газа в серный ангидрид в присутствии оксидов азота. Примерами гомогенного катализа в растворах могут служить кислотный катализ и основной катализ в реакциях синтеза различных органических соединений. Эти процессы сопровождаются присоединением или отщеплением протона на одной из стадий процесса. Гомогенный катализ в растворах часто осуществляется с использованием ионов переходных металлов. В этих случаях в качестве промежуточных соединений образуются комплексы соответствующих ионов с молекулами реагирующих веществ. Одним из видов гомогенного катализа является автокатализ. В этом случае катализатором является один из продуктов реакции. Например, окисление пероксида водорода перманганат-ионами:5H2O 2 + 2MnO4- + 6H+ 2Mn+2 + 5O 2 + 8H 2O протекает медленно, но ионы Mn+2 ускоряют эту реакцию. Поэтому скорость реакции увеличивается по мере накопления ионов Mn+2. Если нужно, чтобы реакция с самого начала протекала быстро, в реакционную среду следует ввести некоторое количество соли марганца (II).
|
|
|
28.Дисперсные системы, их классификация, устойчивость и коагуляция. Коллоидные и истинные растворы. Способы выражения состава растворов. Дисперсные системы – системы, в которых вещество находится в состоянии более или менее высокой раздробленности и равномерно распределено в окружающей среде. Дисперсная система состоит из дисперсионной среды и дисперсной фазы. Вещество, которое в дисперсионной системе образует сплошную фазу наз. дисперсной средой. То, что растворено в виде частиц, капель, пузырьков – дисперсной фазой. Существует несколько классификаций дисперсных систем.По агрегатному состоянию дисперсионной среды все дисперсные системы можно свести к 3 типам. Дисперсные системы с газообразнойдисперсионной средой - аэрозоли (дым, воздух рабочих помещений, облака и т.д.). Дисперсные системы с жидкой дисперсионной средой - лиозоли (пены, эмульсии - молоко, суспензии, пыль, попавшая в дыхательные пути; кровь, лимфа, моча представляют собой гидрозоли). Дисперсные системы с твердой дисперсионной средой - солидозоли (пемза, силикагель, сплавы).Вторая классификация группирует дисперсные системы в зависимости от размера частиц дисперсной фазы: грубодисперсные системы(гетерогенная сист(суспензия мела),слабое проявление поверхностной энергии,дифракция отсутствует); коллоидные растворы(микрогетерогенная сист(яичный белок),очень слабо выражена дифракция,проявляется поверхн.натяж); истинные растворы(гомогенная сист(р-р глюкозы),хорошо выражена дифракция,отсутствие проявления поверхн.энерг). Коллоидные системы могут быть газообразными, жидкими и твердыми. Наиболее распространены и изучены жидкие (лиозоли). Коллоидные растворы для краткости обычно называют золями. В зависимости от природы растворителя - дисперсионной среды, т.е. воды, спирта или эфира, лиозоли называют соответственно гидрозоли, алкозоли или этерозоли. По интенсивности взаимодействия частиц дисперсной фазы и дисперсионной среды золи делят на 2 группы: лиофильные - интенсивное взаимодействие, в результате которого образуются развитые сольватные слои, например, золь протоплазмы, крови, лимфы, крахмала, белка и т.д.; лиофобные золи - слабое взаимодействие частиц дисперсной фазы с частицами дисперсионной среды. Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса DG ® min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина: где где Nа– число Авогадро, а– линейный размер (ребро) частиц, K – постоянная Больцмана; Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями: Изотермическая перегонка, т. е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина; За счет слипания частиц, т.е. коагуляцией. В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.При нарушении агрегативной устойчивости происходит коагуляция. Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.Различают две стадии коагуляции.1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.2 стадия - явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.Правила коагуляции: Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ck. чем меньше порог коагуляции, тем больше коагулирующая способность электролита. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом–коагулянтом. Коагулирующая способность иона–коагулянта тем больше, чем больше заряд иона. Правило устанавливает, что коагулирующие силы иона тем больше, чем больше его валентность. Концентрация раствора – это масса или количество растворенного вещества в определенном количестве, массе или объеме раствора или растворителя.Наиболее распространены следующие способы выражения концентрации растворов.При постоянной массе раствораа) Массовая доля (масс.%) – это масса растворенного вещества, содержащаяся в 100 единицах массы раствора.б) Молярная доля – Xi – число молей растворенного вещества в 100 молях раствора.При постоянной массе растворителя1) Моляльная концентрация Сm – количество молей растворенного вещества, содержащихся в 1 кг растворителя [моль/кг].При постоянном объеме раствораа) Молярная концентрация СМ– количество молей растворенного вещества, содержащаяся в 1 литре раствора [моль/л].б) Молярная концентрация эквивалентов (нормальная концентрация) СН – количество молей эквивалентов вещества, содержащаяся в 1 литре раствора [моль/л].В) Титр раствора Т – масса растворенного вещества, содержащаяся в 1 миллилитре раствора [г/мл].Молярная, массовая доли могут быть выражены в % (умножением на 100); промилле, 0/00 (умножением на 1000); в частях на миллион, ppm (умножением на 106); в частях на миллиард, ppb (умножением на 109).Пользуясь растворами, концентрация которых выражена молярной концентрацией эквивалентов, можно рассчитать объемные отношения реагирующих веществ, так как вещества реагируют в эквивалентных количествах, тообъемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов: V1/V2 = CН2/СН1
|
|
|
|
|
|
29.Растворимость газов, жидкостей и твердых веществ в жидкостях. Закон Генри. Закон распределения. 1.Растворы – гомогенные (однофазные) системы, состоящие из растворенных веществ, растворителей и продуктов их взаимодействия.Из - за непостоянства состава растворов и неприменимости к ним основных химических законов растворы приближены к механическим смесям.С химическими соединениями их роднит однородность, химический состав веществ, в них находящихся.Растворы по агрегатному состоянию делятся на три группы: газообразные (воздух), жидкие (водные и спиртовые растворы), твердые (стекло, сплавы металлов).2.Растворимость – процесс взаимодействия частиц растворенного вещества и растворителя, который может сопровождаться выделением или поглощением энергии, изменением объема раствора.Д.И.Менделеев установил, что при растворении протекают одновременно два процесса: физический – равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический – взаимодействие растворителя и растворяемого вещества.Он создал гидратную теорию растворов, согласно которой между частицами растворенноговещества и молекулами воды образуются химические соединения – гидраты, а сам процесс называется гидратацией. В случае если растворителем является не вода, то соединения называются сольватами, а процесс – сольватацией.А) Растворимость газов: газы способны растворяться в жидкостях лишь до некоторого предела, соответствующего насыщению раствора. На растворимость газов оказывают влияние в жидкостях оказывают влияние природа газов и жидкости, температура, давление. Газы, молекулы которых имеют неполярную связь, лучше растворяются в неполярных растворителях (толуоле, эфире). В полярных растворителях (вода, этиловый спирт) лучше растворяются газы с полярным типом связи.Закон Генри выражает зависимость растворимости газов от давления: растворимость данного газа в жидкости пропорциональна его давлению над жидкостью: С= К х р,где С- концентрация газа в жидкости; К – коэффициент пропорциональности, зависящий от природы газа; р – давление газа над раствором.следствие из закона Генри: объем растворенного газа не зависит от внешнего давления, т.к. при увеличения давления в одинаковое число возрастают концентрации растворенного газа и газа над раствором: К= Сж/Сг, где К – коэффициент пропорциональности; Сж – концентрация газа в жидкости; Сг – концентрация газа над раствором.Б) Растворимость жидкостей зависит от природы жидкостей, различаются три вида систем:- системы, состоящие из смешивающихся друг с другом в любых соотношениях жидкостей, при этом образуется однородный раствор (вода и этиловый спирт, вода и уксусная эссенция);- системы, в состав которых входят жидкости, обладающие ограниченной растворимостью друг в друге (вода и анилин). При растворении данных жидкостей в итоге образуется двухслойная гетерогенная система, в которой при повышении температуры исчезает граница слоев. Такая температура носит название критической температуры растворения. Критическая температура растворения используется для аналитических определений продуктов (маргарин и сливочное масло).- системы из практически нерастворимых друг в друге жидкостей (вода и масло).Закон распределения: отношение концентраций вещества, распределяющегося между двумя несмешивающимися жидкостями, является для каждой температуры величиной постоянной, не зависящей от абсолютных и относительных количеств каждого из растворителей и распределяемого вещества.С1/С2=К,где С1- концентрация вещества в первой жидкости, С2 – концентрация вещества во второй жидкости; К – коэффициент распределения.В) Процесс растворения твердых веществ в жидкости состоит в разрушении кристаллической решетки и диффузии вещества в объем.
30.Давление насыщенного пара растворителя над раствором. Первый закон Рауля Давление пара растворителя над раствором. Закон Рауля. Между жидкостью и ее насыщенным паром существует динамическое равновесиежидкость↔ насыщенный пар,т.е. число молекул жидкости, испаряющихся с поверхности, равно числу конденсирующихся молекул. Этому равновесию соответствует давление насыщенного пара растворителя над чистым растворителем 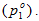 Нижний индекс (1) обозначает то, что свойство относится к растворителю; (2) – к растворенному веществу, а верхний индекс (о) указывает на то, что это свойство вещества в чистом состоянии; в данном случае это свойство чистого растворителя. В 1882 г. французский ученый Рауль сформулировал закон, названный его именем: давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:
Нижний индекс (1) обозначает то, что свойство относится к растворителю; (2) – к растворенному веществу, а верхний индекс (о) указывает на то, что это свойство вещества в чистом состоянии; в данном случае это свойство чистого растворителя. В 1882 г. французский ученый Рауль сформулировал закон, названный его именем: давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя: 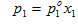 Выражение для молярной массы растворенного вещества
Выражение для молярной массы растворенного вещества  Следовательно, измеряя экспериментально давление насыщенного пара растворителя над раствором можно определить молярную массу растворенного вещества. Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества ΔТкип.=ЕСm(2)ΔТзам..=KСm(2),где Сm(2)Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя. Согласно второму следствию из закона Рауля: эквимолекулрные количества различных неэлектролитов, растворенные в одинаковых количествах по массе одного и того же растворителя увеличивают температуру кипения или понижают температуру замерзания на одно и то же число градусов.
Следовательно, измеряя экспериментально давление насыщенного пара растворителя над раствором можно определить молярную массу растворенного вещества. Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества ΔТкип.=ЕСm(2)ΔТзам..=KСm(2),где Сm(2)Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя. Согласно второму следствию из закона Рауля: эквимолекулрные количества различных неэлектролитов, растворенные в одинаковых количествах по массе одного и того же растворителя увеличивают температуру кипения или понижают температуру замерзания на одно и то же число градусов.
 2018-01-21
2018-01-21 1688
1688








