Скорость химической реакции в однородной среде. Константа скорости.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Гомогенной называется система, состоящая из одной фазы. Например, помутнение раствора, вызываемое появлением серы, происходит во всем объеме. H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2 + S ¯
Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
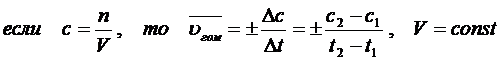 |
Средняя скорость гомогенной реакции, протекающей в статистических условиях, определяется как изменение концентрации веществ в единицу времени:
Чаще всего концентрацию выражают в моль/л.
Односторонняя реакция в статистических условиях: A ® B
Чтобы выражение для скорости было всегда положительным, необходимо
в правой части уравнения выбирать знак «+» или «-» в зависимости от того, по изменению какой концентрации (реагента или продукта) выполняется расчет.
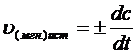 |
В кинетике чаще используется понятие истинной(мгновенной)скорости реакции,
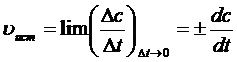 |
В каждый момент времени скорость реакции равна тангенсу угла наклона кривой с = f(t) в данной точке.
Константа скорости.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Зависимость скорости реакции от температуры. Теория активных столкновений и теория активированного комплекса.
 Теория активных столкновений (ТАС)
Теория активных столкновений (ТАС)
Эта теория базируется на двух общих положениях:
Реакция осуществляется в момент столкновения двух молекул А и В;
Столкновение молекул приводит к химическому превращению
 только в том случае, когда молекулы А и В обладают достаточно большим запасом энергии. Эта энергия необходима для преодоления действия сил отталкивания, проявляющихся при сближении любых валентно-насыщенных молекул. N
только в том случае, когда молекулы А и В обладают достаточно большим запасом энергии. Эта энергия необходима для преодоления действия сил отталкивания, проявляющихся при сближении любых валентно-насыщенных молекул. N
T1
T2 T2 > T1
Eакт
Еср Екр Е
 |
А + В = АВ.
|
 |
Согласно теории Аррениуса, каждое столкновение активных молекул А и В должно приводить к образованию продукта реакции. Число активных столкновений описывается на основании уравнения Больцмана:
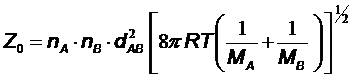 |
Теория активных столкновений построена на з-не:
|


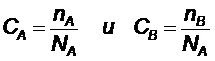 Согласно закону действующих масс
Согласно закону действующих масс 
|
|
Приравниваем выражения для скорости и получаем:

 |
k0 =const
реакции нормальные если k0= 1014
реакции медленные если k0= 10-2 – 10-7
реакции быстрые к0>1014
Недостатки теории ТАС: несовпадение экспериментально и теоретически рассчитанных величин константы скорости реакции.
 2018-01-21
2018-01-21 616
616







