электрометаллургия – это область, охватывающая всю совокупность э/х методов получения металлов электролизом.
1) Получение металлов и др. соединений. Именно э/х методом получают сегодня все щелочные и щелочноземельные металлы, а также Аl. Например:
Na, получают электролизом расплава каустической соды NaOH;
Mg - электролизом расплава MgCl2;
Al - электролизом расплава криолита и глинозема (Na3AlF6 + Al2O3). Необходимо в данных процессах поддерживать высокую температуру (» 1000°С) – это весьма энергоёмкие процессы.
Электролизом получают F2, Cl2, O2, H2, а также гидроксиды щелочных и щелочноземельных металлов (образующиеся в результате вторичных реакций).
F2 получают электролизом смеси NaF + HF;
Cl2 и NaOH – из водного раствора NaCl;
H2 и O2 – электролизом Н2О + NaOH (или H2SO4, или Na2SO4, которые необходимо вводить в электролит для увеличения электропроводности и уменьшения омического сопротивления).
Особый интерес представляет возможность получения сложных химических соединений с помощью электролиза – электросинтеза.
2) Направление применения электролиза в металлургии – рафинирование металлов (очистка, получение их в чистом виде). Электролитическому рафинированию подвергают металлы: Fe, Cu, Pb, Ag, Au, Sn, Ni и др. металлы. Современная техника предъявляет большие требования к чистоте материалов, в частности металлы. В цветной металлургии для очистки металлов от примесей широко применяют электролиз с растворимым анодом. В наибольшем масштабе этот процесс широко используется для рафинирования меди (Cu). В промышленности, соединения меди восстанавливают с помощью химических восстановителей.
3) Важнейшая область прикладной электрохимии – гальванотехника – включает в себя два основных направления: гальванопластика и гальваностегия.
Гальванопластика – метод электрохимического получения точных металлических копий с рельефных поверхностей.
Путем гальванопластики изготавливают матрицы для прессования различных изделий, матрицей для теснения кожи и бумаги. В настоящее время основным применением гальванопластики является нанесение металлических рисунков на полупроводники и на проводящие материалы (например в производстве печатных плат, радиосхем).
Гальваностегия – получение металлических покрытий на металлах и пластмассах.
Гальванические покрытия наносят для защиты металлов от коррозии, а также в декоративных и специальных целях (например, для уменьшения сопротивления электрических контактов, увеличения отражательной способности).
Сущность гальванического нанесения покрытий состоит в следующем: хорошо очищенную и обезжиренную деталь погружают в раствор, содержащий соль того металла, которым её необходимо покрыть и присоединяют в качестве катода к цепи постоянного тока. Наибольшая защита обеспечивается при получении плотных мелкокристаллических осадков. Для этого обычно требуется работать с малыми плотностями тока и наоборот – если бы нам потребовалось бы получить металл в состоянии более рыхлом, необходимо пользоваться высокой плотностью тока.
Механизмы коррозии.
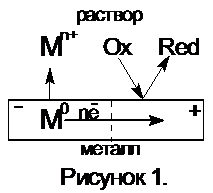
Рассмотрим работу локального микрогальванического элемента на поверхности металла (рис.1). На участке поверхности металла, обладающим более отрицательным значением потенциала (анод), идет реакция растворения металла, коррозия:
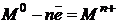 (I)На участке поверхности с более положительным потенциалом (катод) происходит реакция восстановления окислителя, содержащегося в электролите:
(I)На участке поверхности с более положительным потенциалом (катод) происходит реакция восстановления окислителя, содержащегося в электролите:
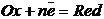 , (II)где Ox – окисленная форма; Red – восстановленная форма.
, (II)где Ox – окисленная форма; Red – восстановленная форма.
Вид катодного процесса зависит от вида среды (от вида окислителя). В природных условиях наиболее частыми катодными процессами являются:
а) в кислой среде (pH < 7) при ограниченном доступе кислорода к металлу катодный процесс идет по схеме:  .
.
Коррозионные процессы, сопровождающиеся восстановлением водорода, называются коррозией с водородной деполяризацией.
б) при большой скорости поступления кислорода в нейтральной (pH=7) или щелочной (pH>7) средах преимущественным является другой процесс:  .
.
В слабокислой среде при условии хорошего доступа кислорода процесс также идет с поглощением кислорода. В этом случае схема катодного процесса имеет следующий вид: 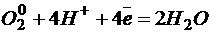 Коррозионные процессы, сопровождающиеся восстановлением кислорода, называются коррозией с кислородной деполяризацией.
Коррозионные процессы, сопровождающиеся восстановлением кислорода, называются коррозией с кислородной деполяризацией.
Процесс отвода электронов с катодных участков называется деполяризацией.
Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами
Коррозия с кислородной деполяризацией наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой равно 0,21 атм.
Ионизация кислорода:
В реальных условиях коррозии металла наиболее затрудненными стадиями процесса являются:
Реакция ионизации кислорода на катоде. Возникающую при этом поляризацию называют перенапряжением кислорода. Говорят, что процесс идет с кинетическим контролем.
Диффузия кислорода к катоду, либо перенапряжение диффузии. В этом случае, говорят, что процесс идет с диффузионным контролем.
Возможны случаи, когда обе стадии – ионизация кислорода и диффузия кислорода оказывают влияние на процесс. Тогда говорят, о кинетически-диффузионном контроле.
Основной электрохимический механизм коррозии может иметь варианты. Анодная реакция при n ³ 2 может протекать через одноэлектронные стадии. Так при n = 2 могут иметь место следующие процессы:  Катион в промежуточной степени окисления M+ в некоторых случаях настолько устойчив, что может вступать в химическую реакцию с окислителем прежде, чем успевает произойти его электрохимическое анодное доокисление:
Катион в промежуточной степени окисления M+ в некоторых случаях настолько устойчив, что может вступать в химическую реакцию с окислителем прежде, чем успевает произойти его электрохимическое анодное доокисление:
 III) (
III) (
В этом случае говорят об э лектрохимическо-химическом механизме коррозии. Схема этого процесса представлена на рисунке 2.
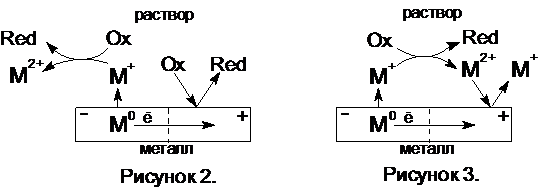
 Еще одной разновидностью электрохимического механизма коррозии является так называемый каталитический механизм (рис.3). Он очень напоминает предыдущий механизм коррозии и отличается от него тем, что протекающая очень быстро реакция (III) препятствует поступлению окислителя к поверхности металла. В результате в катодном процессе восстанавливаются катионы металла (при n=2 -
Еще одной разновидностью электрохимического механизма коррозии является так называемый каталитический механизм (рис.3). Он очень напоминает предыдущий механизм коррозии и отличается от него тем, что протекающая очень быстро реакция (III) препятствует поступлению окислителя к поверхности металла. В результате в катодном процессе восстанавливаются катионы металла (при n=2 -  ):
):
 .
.
Ионы  в этом случае играют роль катализатора процесса коррозии.
в этом случае играют роль катализатора процесса коррозии.
На рисунке 4 приведена схема газовой коррозии в среде кислорода. В общем виде уравнение реакции можно записать так:
 .
.
Окисление металлов – процесс многостадийный. В результате взаимодействия вначале на поверхности образуется моно-, а затем полимолекулярный слой оксидов. По мере утолщения пленки процессы встречной диффузии реагентов затрудняются. Образующаяся оксидная пленка будет тормозить дальнейшее развитие коррозионного процесса. Однако это будет происходить только в том случае, если пленка будет обладать защитными свойствами.
 2018-01-21
2018-01-21 1466
1466