20) ориентационное взаимодействие - если вещество состоит из полярных молекул, например молекул H2O или НСl, то в конденсированном состоянии соседние молекулярные диполя ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение. Индукционное взаимодействие – в случае веществ, состоящих из неполярных, но способных к поляризации молекул, например СО2, наблюдается наведение или индуцирование диполей. Причина их появления обычно состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется, и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы. В результате этого происходит взаимное притяжение молекул друг к другу. Дисперсионное взаимодействие – движение электронов в атомах, а также колебание ядер связанное с этим непрерывное изменение взаимного положения электронов и ядер вызывают появление мгновенных диполей. Как показывает квантовая механика, мгновенные диполи возникают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к притяжению.
Межмолекулярное взаимодействие, взаимодействие между электрически нейтральными молекулами или атомами; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физических явлениях. М. в. зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) (потенциалом М. в.), так как именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества.
21) Условием образования водородной связи является высокая ЭО атома, непосредственно связанного в молекуле с атомом водорода. Энергия водородной связи меньше энергии обычной ковалентной связи.

22)Максимальная степень окисления зависит от номера группы, и определяет характер веществ(оксиды, гидроксиды-амф, кисл). Так же по номеру группы мы можем узнать кол-во электронов на внешнем энергетическом уровне. По периоду можно определить кол-во подуровней.По положению в таблице можно судить о том, как изменяются различные характеристики элементов: радиус, ЭО, энергия ионизации, сродство к электрону.
23) В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в третьем периоде натрий — самый активный в периоде восстановитель, а хлор — самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Лучшие восстановители — щелочные металлы, а наиболее активные из них Fr и Cs. Лучшие окислители— галогены. Элементы главных подгрупп IV-VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять восстановительные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью.
Элементы побочных подгрупп (четных рядов) больших периодов имеют металлический характер, так как на внешнем уровне их атомов содержится 1-2 электрона. Поэтому их простые вещества являются восстановителями. В отличие от простых веществ металлов, выступающих в роли восстановителей, простые вещества неметаллы проявляют себя и как окислители, и как восстановители.
Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента.
24) Влияние среды на характер протекания реакций
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+-ионов), нейтральной (Н2O) и щелочной (избыток гидроксид-ионов OH-). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион MnO-4 в кислой среде восстанавливается до Mn2+, в нейтральной — до MnO2, а в щелочной — до MnO2-4.
25) Атом, находящийся в минимальной степени окисления, может быть только восстановителем. Атом, находящийся в максимальной степени окисления, может быть только окислителем. Атом, находящийся в промежуточной степени окисления, может быть как восстановителем, так и окислителем. Это зависит от того, с каким веществом он реагирует. Говоря иначе, есть атом обладает окислительно-восстановительной двойственностью. Из простых веществ только восстановителями могут быть атомы металлов.Они являются лучшими восстановителями. Из сложных веществ восстановителями являются соединения, в состав которых входят атомы элемента в минимальной степени окисления(HBr). В периодах с возрастанием атомного номера элементов их восстановительные свойства ослабевают. Это связано с увеличением заряда ядра и уменьшением атомного радиуса. В главных подгруппах с увеличением номера периода восстановительные свойства элементов возрастают. Это связано с увеличением атомного радиуса. Из простых веществ только окислителями могут быть атомы фтора и кислорода.Исключение – кислород в реакции со фтором. Из сложных веществ окислителями являются практически все кислоты – то есть соединения, в состав которых входят атомы элементов в максимальной степени окисления(SO3). В периодах слева направо (с увеличением заряда ядра и уменьшением атомного радиуса) окислительные свойства элементов усиливаются. В главных подгруппах сверху вниз (с увеличением атомного радиуса) окислительные свойства элементов ослабевают.

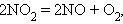 26) Все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества: Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
26) Все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества: Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
Метод полуреакций или метод ионно-электронногобалансаприменяют при составлении уравнений сложных реакций, протекающих в водных растворах или расплавах. При нахождении коэффициентов в уравнении реакциируководствуются правилами: Если исходные вещества содержат большее число атомов кислорода, чем полученные продукты, то освобождающийся кислород в кислой среде с ионами водорода образует воду, а в нейтральной и щелочной средах с молекулами воды – гидроксид-ионы. Если исходные вещества содержат меньшее число атомов кислорода, чем образующиеся, то недостающее число атомов кислорода восполняется в кислой и нейтральной средах за счет молекул воды, а в щелочной – за счет ионов ОН-. 1. Определим вещество, которое является окислителем и восстановителем. 2. Составим полуреакцию процесса восстановления, учитывая среду. Для определения числа электронов, участвующих в процессе восстановления, вычислим сумму зарядов в левой и правой части полуреакции. Уравняем число зарядов. По аналогии с полуреакцией восстановления, составим полуреакцию процесса окисления. 4.Суммируем обе полуреакции. Из ионно-молекулярного составляем уравнение в молекулярной форме присоединяя те ионы, которые присутствовали в исходных реагентах.
Метод полуреакций для уравнивания ОВР.
Метод полуреакций является удобным и универсальным методом уравнивания окислительно-восстановительных реакций. Методом полуреакций можно уравнять даже такие реакции, которые крайне сложно уравнять другими методами (см. примеры в конце). Прелесть метода заключается в том, что именно в форме полуреакций записаны справочные данные по стандартным электродным потециалам. А это значит, что большинство необходимых полуреакций можно брать прямо из справочников!
Алгоритм.
Вспомним, что такое степень окисления, окислитель и восстановитель.
Fe + 2HCl = FeCl2 + H2
Руководствуясь здравым смыслом и значениями электроотрицательностей, определим степени окисления каждого элемента в каждом соединении в левой и правой частях уравнения. У нас должна получиться такая картина:
Fe0 → Fe+2 - элемент потерял электроны, повысил степень окисления (окислился);
H+1 → H0 - элемент получил электроны, понизил степень окисления (восстановился);
Cl-1 → Cl-1 - степень окисления элемента не изменилась.
Полуреакцией восстановления называется реакция, описывающая превращение элемента-окислителя, записанная в ионном виде:
2H+ +2e- = H2
Полуреакцией окисления называется реакция, описывающая превращение элемента-восстановителя, записанная в ионном виде:
Fe = Fe2+ + 2e-
**************
Полуреакции восстановления некоторых веществ.
MnO4- + 8H+ + 5e-= Mn2+ + 4H2O (кислая среда, Mn+7 → Mn+2);
MnO4- + 4H+ + 3e- = MnO2 + 2H2O (нейтральная среда, Mn+7 → Mn+4);
MnO4- + e- = MnO42- (щелочная среда, Mn+7 → Mn+6);
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O (Cr+6 → Cr+3)
CrO42- + 4H2O + 3e-= [Cr OH)6]3- + 2OH- (то же; не забываем про равновесие 2CrO42- + 2H+ = Cr2O72- + H2O)
2XO3- + 10H+ + 10e- = X2 + 5H2O (X+5 → X0) (X = Cl, Br, I)
X2 + 2e- = 2X- (X = Cl, Br, I)
2H+ +2e- = H2 (H+ → H0)
SO42- + 4H+ + 2e- = SO2 + 2H2O (S+6 → S+4)
SO42- + 8H+ + 6e- = S + 4H2O (S+6 → S0)
NO3- + 2H+ + e- = NO2 + H2O (N+5 → N+4)
NO3 + 4H+ + 3e- = NO + 2H2O (N+5 → N+2)
2NO3- + 12H+ + 10e- = N2 + 6H2O (N+5 → N0)
27) КMnO4- один изсаамы сильных окислителей. Наиболее силноокислительныесв-ва проявляются в кислой среде, т. К. принимает 5 электронов и восстанавливается до MnO2. В щелочной среде окислительные свойства проявляются слабее, т.к. принимает только 1 электро и восстанавливается дом K2MnO4. Краска меняется с фиолетовой на бурую(нейтрал), бесцветную(кислая), сине-зеленая(щелочная). Растворы KMnO4 в медицине применяют как бактерицидное и прижигающее средство, слабыми рами промывают слизистые оболочки.
28)Степень окисления кислорода в Н2O2= -1, т.е. находится в промежуточной степени окисления, а, следовательно, пероксид водорода проявляет окислительно-восстановительную двойственность. Например в реакции с KNO2- является окислителем, а в реакции с KMnO4 в кислой среде- является восстановителем, а в реакции при разложении Н2О2 происходит диспропорционирование,т.е образуется Н2О и О2.. В медицине применяют 3% раствор, как дезинфицирующее действие, 30% раствор используют для лечения бородавчатой формы красного плоского лишая и для удаления юношеских бородавок.
29)
| Кислая рН < 7 | Общая схема: O2- + 2H+ = H2O Примеры: MnO4- + 8H+ +5e = Mn2+ + 4H2O Cr2О72- + 14H+ + 6e = 2Cr3+ + 7H2О |
| Нейтральная рН = 7, щелочная рН > 7 | Общая схема: O2- + H2O = 2OH- Примеры: MnO4- +2H2O+3 e = MnO2 + 4OH- CrO42-+4H2O +3 e =[Cr(OH)6]3- + 2ОН- |
30) Окислительно-восстановительный потенциал- мера способности химического вещества присоединять электроны. Окислительно-восстановительный потенциал определяют электрохимическими методами. Простейший пример — ионы окисного и закисного железа: Fe3+ — ионы могут захватывать из металла электроны, превращаясь в Fe2+ — ионы, способные к обратной реакции; потенциал, при котором эти реакции динамически уравновешивают друг друга, и есть О.-в. п. Чем сильнее окислительная способность среды, тем он выше. Стандартный электродный потенциал- это потенциал данного электронного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Окислительно-восстановительные потенциалы
Количественной мерой окислительной способности окислителя (и одновременно восстановительной способностиего восстановленной формы) является электрический потенциал электрода φ (электродный потенциал), на котором одновременно и с равными скоростями протекают полуреакция его восстановления и обратная ей полуреакция окисления соответствующей восстановленной формы.
Этот окислительно-восстановительный потенциал измеряется по отношению к стандартному водородному электроду и характеризует пару «окисленная форма – восстановленная форма» (поэтому выражения «потенциал окислителя» и «потенциал восстановителя», строго говоря, неверны). Чем выше потенциал пары, тем сильнее выражена окислительная способность окислителя и, соответственно, слабее – восстановительная способность восстановителя.
И напротив: чем ниже потенциал (вплоть до отрицательных значений), тем сильнее выражены восстановительные свойства восстановленной формы и слабее - окислительные свойства сопряженного с ней окислителя.
Типы электродов, конструкция стандартного водородного электрода и методы измерения потенциалов детально рассматриваются в курсе физической химии.
Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Направление химических реакций.
В механических системах устойчивое равновесие соотв-ет минимуму потенциальной энергии системы. Хим. процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положит-му тепловому эффекту реакции. При обычныхусл. самопроизвольно протекают преимущ-но экзотермические реакции. Так же, уже при обычных t-рахсамопр-но протекают эндотермические процессы растворения мн. солей и некоторые эндотерм. хим. р-ции. С повыш. t-ры все большее число реакций начинает самопр-но протекать в направ. эндотерм. процесса. Принцип стремления к минимуму внутренней энергии требует, чтобы все экзотерм. р-ции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции сущ-ют. Среди мех-ких систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Из громадного числа частиц состоят и хим. системы. Тенденция к достижению минимума внутр. энергии не явл. единств.фактором, определяющим их поведение. Для представления о 2-м факторе, влияющем на на-правление р-ций, рассм. процесс, не сопровождающийся тепловым эффектом. Н-р, расширение разряж-го газа. С ростом числа молекул вер-стьбеспоряд-го, равно-мерногораспред-ния газа в сосуде очень быстро возрас-тает, а самопроиз-ное сжатие газа становится все менее вероятным процессом. Макроскоп. кол-ва газа содержат огромное число молекул, соотв-но в реальном опыте самопр-ное сжатие газа предст. собой процесс практически невозможный, и что самопр-но будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядоч. распред-ю его молекул по всему объему сосуда.
Направление самопроизвольного протекания химиче-ских реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
При хим. реакциях в силу принципа направл-типроцес-сов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наиб.кол-во энергии. В силу же принципа направленно-сти процессов к наиболее вероятному состоянию проте-кают такие реакции, в ходе которых возрастает число частиц (н-р, р-ции разложения молекул на атомы) или чисто возможных состояний атомов. Тенденция к переходу в состояние с наименьшей внут-ренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
 2018-01-21
2018-01-21 1096
1096






