Стандартная энтальпия нейтрализации — Δ H нейтро энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
HCl + NaOH = NaCl + H2O
H+ + OH− = H2O, ΔHнейтр° = −55,9 кДж/моль
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствие изменения значения ΔHгидратации° ионов при разбавлении.
4 хз(
Эта на подобии
Какую массу гидроксида кальция нужно добавить к 250 литрам воды, чтобы устранить карбонатную жесткость, равную 5,5 ммоль/литр?
Решение:
Са(ОН)2 + Са2+ = Н2О + 2Са+
(Mg2+)
nэкв(Са2+) + Mg2+) = nэкв(реаг) = nэкв (продукт)
Ж = (mреаг)/(Эmреаг * Vл)
mреаг = Ж * Эmреаг * Vводыл
Эm(Са(ОН)2) = М * Э = 74/2 = 37 мг/ммоль
mреаг = 37 * 250 * 5,5 = 50875 мг = 50,875 грамм
5) Протекторная защита металла от коррозии.
Протекторная защита металла — способ антикоррозионной защиты, при котором защищаемой поверхности необходимо обеспечить контакт с более активным металлом (ссылка). По отношению к железу, более активными металлами являются кадмий, хром, цинк, магний и другие металлы.
Из механизма коррозии металла, следует, что более активный металл начинает испускать электроны и присоединять к образовавшимся ионам гидроксильной группы из раствора электролита, а другой, менее активный, будет принимать электроны, присоединяя их к своим ионам. В результате, более активный металл — анод — будет окисляться, а менее активный металл — катод восстанавливаться. Таким образом, анод будет защищать от коррозии
Протекторная защита нашла широкое применение для защиты таких объектов как: подземные трубопроводы, резервуары, морские и речные суда и др. Все эти объекты находятся в постоянном контакте с электролитом, будь то грунтовые воды, химические растворы, морская или речная вода.
Для реализации протекторной защиты необходимо обеспечить соприкосновение самого протектора с чистой поверхностью защищаемого металла См. Рис. 1.
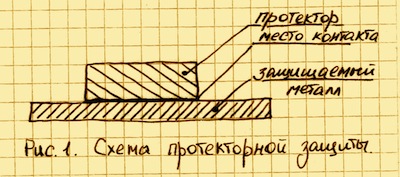
Если на эту конструкцию будет воздействовать внешняя среда, то электроны протектора будут переходить в защищаемый металл и на катоде начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами OH), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор. Таким образом, обеспечивается катодная защита металла до тех пор, пока протектор полностью не разрушится вследствие коррозии. После полного разрушения начнет корродировать и сам металл.
Среди лакокрасочных материалов выделят класс протекторных грунтовок (цинконаполненных или цинкосодержащих). Применение данного вида материалов получило название «холодное цинкование». Механизм их действия мы опишем в следующих постах.
Билет№ 21
1) Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение
Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4равна 98,0 г/моль. Следовательно, масса одной молекулы 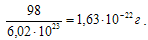
2)Электронная формула серы - 1s 22s 22p 63s 23p4
Электронная формула титана - 1s 22s 22p 63s 23p64s 23d2
3)Во сколько раз изменится скорость прямой и обратной реакции…
| 2SO2(г)+O2(г)↔2SO3(г) v1=3*v2 | |||
Найти: υпр2/υпр1-? υобр2/υобр1-?
1) 2SO2(г)+O2(г)↔2SO3(г)
υпр2=k*[SO2(г)]22*[O2(г)]2=k*v22*v2=k*v23
3) Смесь гомогенная и газовая, следовательно, концентрация пропорционально объёму, поэтому вместо неё можно подставим соответствующие объёмы. Записываем выражение скорости реакции для прямой реакции υобр1=k*[SO3(г)]12=k*v12=k*(3*v2)2=9*k*v22 υобр2=k*[SO3(г)]22=k*v22 υобр2/υобр1=k*v22/9*k*v22=1/9 Ответ: скорость прямой реакции уменьшилась в 27 раз, а обратной в 9 раз. |
4)Какие металлы будут взаимодействовать с растворами щелочей.
В растворах щелочей растворяются только те металлы, которые имеют
отрицательный стандартный электродный потенциал, т.е. находятся левее во-
дорода в ряду активности и при этом образуют амфотерные гидроксиды (Be, Al,
Zn, Sn, Pb). Процесс растворения такого металла в щелочи состоит из двух ста-
дий:
1) лишенный оксидной пленки металл взаимодействует с водой:
Be + 2H2O → Be(OH)2 + H2
2) образующийся амфотерный гидроксид взаимодействует со щелочью:
Be(OH)2 +2NaOH → Na2[Be(OH)4].
Суммарный процесс выглядит следующим образом:
Be + 2H2O + 2NaOH → Na2[Be(OH)4] + H2.
В растворах солей варианты поведения металлов могут быть различны-
ми:
1) металл с меньшим стандартным электродным потенциалом будет вытеснять,
т.е. восстанавливать металл с большим стандартным потенциалом из его соли;
2) многие соли в водных растворах сильно гидролизованы, что приводит к вто-
ричным реакциям активных металлов с кислотами или щелочами, являющими-
ся продуктами гидролиза соли. Например, при нагревании алюминия с раствором карбоната натрия на-блюдается выделение водорода. Алюминий не может восстановить натрий, т. к. ΔЕ0(Al3+/Al0) = -1,7 B > ΔЕ0(Na+/Na0)= -2,71 B. Карбонат натрия гидролизуется поаниону, подщелачивая раствор: Na2CO3 + H2O = NaHCO3 + NaOH. Алюминий взаимодействует с водным раствором щелочи с выделениемводорода: 2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2 Суммарный процесс можно записать следующей реакцией:2Na2CO3 + 2Al++8H2O → 2NaHCO3+ 2Na[Al(OH)4] + 3H25) Жи́дкое стекло́(растворимое) — водный щелочной раствор силикатов натрия Na2O(SiO2)n и (или) калия K2O(SiO2)n[1]. Реже в качестве жидкого стекла используют литиевые силикаты, например, в электродном покрытии.
Получение
Впервые жидкое стекло получил в 1818 немецкий химик и минеролог Ян Непомук фон Фукс.
В настоящее время изготовляется путем обработки в автоклаве кремнезёмсодержащего сырья концентрированными растворами гидроксида натрия или сплавлением кварцевого песка с содой. Известны также способы получения жидкого стекла, основанные на прямом растворении кремнистого сырья (Опоки, трепелы, диатомиты и др.) в растворах щелочей при атмосферном давлении и относительно невысокой температуре (температура кипения раствора щелочи).
Характеристикой химического состава жидкого стекла является силикатный модуль. Модуль показывает отношение содержащейся в жидком стекле окиси кремния к окиси натрия или к окиси калия и характеризует выход кремнезема в раствор. По величине силикатного модуля о качестве жидкого стекла не судят.
Применение
Областей применения жидкого стекла очень много. Его, в частности, применяют для изготовления кислотоупорного цемента и бетона, для пропитывания тканей, приготовления огнезащитных красок и покрытий по дереву (антипирены), укрепления слабых грунтов, в качестве клея для склеивания целлюлозных материалов, в производстве электродов, при очистке растительного и машинного масла и др.
В сочетании со спиртом и самым мелким песком используют для создания «керамических» или оболочечных форм, в которые после прокаливания до 1000 градусов отливают металлические изделия.
С 2008 года несколько японских производителей автополиролей начали выпуск полиролей на основе жидкого стекла.
Билет№22
1) Гидроксиды же одновалентных металлов, очевидно, вообще не могут образовывать основных солей.Cu, Ca.
Cu(OH)2+HCl=Cu(OH)Cl+H2O
2) Какое максимальное число электронов могут занимать s-, р-, d- и f-орбитали данного энергетического уровня? Почему?
Принцип Паули позволяет рассчитать максимальное число электронов на каждом энергетическом уровне и подуровне в атоме. Максимальное число электронов на подуровне с орбитальным квантовым числом l равно 2(2l + 1). При l = 0 (s-подуровень) магнитное квантовое число тоже равно нулю. Следовательно, на s-подуровне имеется всего одна орбиталь, и максимальное число электронов на s-подуровне каждого электронного слоя равно двум. При l = 1 (p-подуровень) магнитное квантовое число ms может принимать три значения. На трёх p-орбиталях может находиться не более шести электронов. При l = 2 (d-подуровень) магнитное квантовое число может принимать пять значений и, следовательно, на пяти d-орбиталях может находиться до 10 электронов. При l = 3 (f-подуровень) магнитное квантовое число может принимать семь значений, следовательно, на семи d-орбиталях может находиться до 14 электронов.
§ 3)Во сколько раз изменится скорость прямой и обратной реакции…
| 2SO2(г)+O2(г)↔2SO3(г) v1=3*v2 | |||
Найти: υпр2/υпр1-? υобр2/υобр1-?
1) 2SO2(г)+O2(г)↔2SO3(г)
υпр2=k*[SO2(г)]22*[O2(г)]2=k*v22*v2=k*v23
3) Смесь гомогенная и газовая, следовательно, концентрация пропорционально объёму, поэтому вместо неё можно подставим соответствующие объёмы. Записываем выражение скорости реакции для прямой реакции υобр1=k*[SO3(г)]12=k*v12=k*(3*v2)2=9*k*v22 υобр2=k*[SO3(г)]22=k*v22 υобр2/υобр1=k*v22/9*k*v22=1/9 Ответ: скорость прямой реакции уменьшилась в 27 раз, а обратной в 9 раз. |
§ 4)Какие металлы будут взаимодействовать с растворами щелочей.
§ В растворах щелочей растворяются только те металлы, которые имеют
§ отрицательный стандартный электродный потенциал, т.е. находятся левее во-
§ дорода в ряду активности и при этом образуют амфотерные гидроксиды (Be, Al,
§ Zn, Sn, Pb). Процесс растворения такого металла в щелочи состоит из двух ста-
§ дий:
§ 1) лишенный оксидной пленки металл взаимодействует с водой:
§ Be + 2H2O → Be(OH)2 + H2
§ 2) образующийся амфотерный гидроксид взаимодействует со щелочью:
§ Be(OH)2 +2NaOH → Na2[Be(OH)4].
§ Суммарный процесс выглядит следующим образом:
§ Be + 2H2O + 2NaOH → Na2[Be(OH)4] + H2.
§ В растворах солей варианты поведения металлов могут быть различны-
§ ми:
§ 1) металл с меньшим стандартным электродным потенциалом будет вытеснять,
§ т.е. восстанавливать металл с большим стандартным потенциалом из его соли;
§ 2) многие соли в водных растворах сильно гидролизованы, что приводит к вто-
§ ричным реакциям активных металлов с кислотами или щелочами, являющими-
§ ся продуктами гидролиза соли.§ Например, при нагревании алюминия с раствором карбоната натрия на-§ блюдается выделение водорода. Алюминий не может восстановить натрий, т. к.§ § ΔЕ0(Al3+/Al0) = -1,7 B > ΔЕ0(Na+/Na0)= -2,71 B. Карбонат натрия гидролизуется по§ аниону, подщелачивая раствор:§ Na2CO3 + H2O = NaHCO3 + NaOH.§ Алюминий взаимодействует с водным раствором щелочи с выделением§ водорода:§ 2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2 § Суммарный процесс можно записать следующей реакцией: § 2Na2CO3 + 2Al++8H2O → 2NaHCO3+ 2Na[Al(OH)4] + 3H2§
§ 5) Жи́дкое стекло́(растворимое) — водный щелочной раствор силикатов натрия Na2O(SiO2)n и (или) калия K2O(SiO2)n[1]. Реже в качестве жидкого стекла используют литиевые силикаты, например, в электродном покрытии.
Получение
§ Впервые жидкое стекло получил в 1818 немецкий химик и минеролог Ян Непомук фон Фукс.
§ В настоящее время изготовляется путем обработки в автоклаве кремнезёмсодержащего сырья концентрированными растворами гидроксида натрия или сплавлением кварцевого песка с содой. Известны также способы получения жидкого стекла, основанные на прямом растворении кремнистого сырья (Опоки, трепелы, диатомиты и др.) в растворах щелочей при атмосферном давлении и относительно невысокой температуре (температура кипения раствора щелочи).
§ Характеристикой химического состава жидкого стекла является силикатный модуль. Модуль показывает отношение содержащейся в жидком стекле окиси кремния к окиси натрия или к окиси калия и характеризует выход кремнезема в раствор. По величине силикатного модуля о качестве жидкого стекла не судят.
Применение
§ Областей применения жидкого стекла очень много. Его, в частности, применяют для изготовления кислотоупорного цемента и бетона, для пропитывания тканей, приготовления огнезащитных красок и покрытий по дереву (антипирены), укрепления слабых грунтов, в качестве клея для склеивания целлюлозных материалов, в производстве электродов, при очистке растительного и машинного масла и др.
§ В сочетании со спиртом и самым мелким песком используют для создания «керамических» или оболочечных форм, в которые после прокаливания до 1000 градусов отливают металлические изделия.
§ С 2008 года несколько японских производителей автополиролей начали выпуск полиролей на основе жидкого стекла.
Билет 23
1) сколько молей содержит
1 л. р-ра -0,25 моль Na2CO3
0.5 л. р-ра - x моль Na2CO3
n(Na2CO3)=(0.25*0.5)/1=0.125 моль
m (Na2CO3)=106*0.125=13.25 г
2) Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —>Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня.:Cl + 1е -->.Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:

Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
3) Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества c д к общей концентрации вещества c B в растворе):
α = c д / c B
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава H n A степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 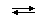 H+ + H2PO4− (α = 23,5%)
H+ + H2PO4− (α = 23,5%)
H2PO4− 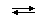 H+ + HPO42− (α = 3 · 10−4%)
H+ + HPO42− (α = 3 · 10−4%)
HPO42− 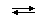 H+ + PO43− (α = 2 · 10−9%)
H+ + PO43− (α = 2 · 10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
В разбавленных растворах сильных кислот H n A их гидроанионы H n -1A не существуют. Например, в случае серной кислоты:
H2SO4 = H+ + [HSO4−] (α1 → 1)
[HSO4−] = H+ + SO42− (α2 → 1)
H2SO4(разб.) = 2H+ + SO42−
В концентрированных растворах содержание гидроанионов (иногда - и исходных молекул) становится заметным:
H2SO4(конц.) 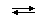 H+ + HSO4− (α1 < 1)
H+ + HSO4− (α1 < 1)
HSO4− 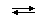 H+ + SO42− (α2 < α1 < 1)
H+ + SO42− (α2 < α1 < 1)
(суммировать уравнения стадий обратимой диссоциации нельзя!)
При нагревании значения 1 и 2 возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Аналогичные закономерности имеют место и для слабых оснований (например гидрата аммиака NH3 · H2O).
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплексраспадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается 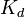 и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
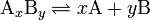
где комплекс  разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так:

где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации  равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул 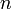 к сумме
к сумме 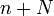 , где
, где  — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто  выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
4) Погрузим медный и цинковый электроды в растворы сульфатов с концентрацией ионов 1 моль/л. Стандартный потенциал цинкового электрода - 0,76 В, а медного - 0,34 В. Напряжение полученного элемента будет равно 0,34 - (-0,76) = 1,1 В. Возьмем медную проволоку, соединим оба электрода, подключим даже приборы для измерения напряжения и тока, но стрелка замерла, тока нет. Мы забыли соединить электроды и "по воде". Соединим стаканы с растворами так называемым электролитным мостом. Он представляет собой тонкую стеклянную трубочку, наполненную электролитом, например KCl. Перегородки, поставленные на обоих концах трубки, мешают свободному переходу ионов из одного раствора в другой. Ионы меди не могут самостоятельно перейти в раствор сульфата цинка и, наоборот, ионы цинка не могут перейти в раствор сульфата меди. Нельзя допустить, чтобы растворы смешались.

Медно-цинковый гальванический элемент с электролитным мостом
После того, как поставлен электролитный мост, гальванический элемент начинает работать: по цепи течет электрический ток. На одном электроде, там, где цинк погружен в раствор сульфата цинка, происходит постоянное растворение металла и движение ионов цинка в растворе:
Zn - 2е- → Zn2+
а на другом электроде постоянно выделяется медь:
Cu2+ + 2е → Cu
Цинк окисляется, а ионы меди восстанавливаются. Для цинка необходимо, чтобы какое-нибудь вещество приняло электроны, от которых он стремится освободиться. Ионы меди, наоборот, нуждаются в таких электронах. Электроны эти движутся по внешней цепи, по проводнику, который соединяет два электрода. Движение потока электронов по проводнику - это и есть электрический ток. Таким образом, за счет химического процесса:
Zn + Cu2+ → Zn2+ + Cu
вырабатывается электрическая энергия.
Но для чего нужен электролитный (солевой) мост. Без такого моста гальванический элемент не работает. Какие изменения происходят вблизи цинковой пластинки, когда с ее поверхности отрываются ионы цинка. Естественно, что концентрация этих ионов в растворе увеличивается. Появляется большое количество положительных ионов, которым нет антиионов в растворе. Слышали ли о таком - раствор, содержащий преимущественно одинаково заряженные ионы? Скорее всего, нет. Растворы сами по себе электронейтральны. Аналогичные изменения наступают и в объеме раствора, в который погружена медная пластинка. Здесь лишними становятся сульфатные анионы SO42-, то есть раствор заряжается отрицательно. Электроны перешли от одного электрода к другому и нарушили электронейтральность раствора. Создавшаяся разность потенциалов должна быть устранена. Этому способствует электролитный мост. По нему анионы SO42- переходят от медного электрода к цинковому в силу этой самой разности потенциалов, но если быть более точными то, в нашем случае анионы SO42-переходят в солевой мост с одной стороны а с другой стороны выходят анионы Cl-. Таким образом, налицо два потока: поток электронов по внешнему проводнику и поток ионов по электролитному мосту.
Ни медный стержень, ни ZnSO4 не являются обязательной частью этого элемента. Металлическая медь осаждается на катоде из любого другого проводника, например на платиновой проволоке, а раствор сульфата цинка в анодной камере можно заменить любой другой проводящей солью, которая не взаимодействует с цинковым анодом, например, хлоридом натрия. В качестве соляного мостика, можно использовать стеклянную U-образную трубку, содержащую какой-либо электролит типа KNO3, смешанный с агар-агаром либо желатиной, чтобы удержать электролит в трубке.
Что если оба металла погрузить в общий раствор, содержащий два вида ионов. Погрузить разумеется, можно, только обмен электронами будет на поверхности цинка, а не через внешнюю цепь. Цинк начнет растворятся постепенно покрываясь ямками, в тоже время покрываясь корочкой меди, которая сформирует губчатое коричневое покрытие. Но солевой мостик создает сопротивление диффузии ионов, создавая электрическое сопротивление, мешающее получению сильного тока от элемента, поэтому наилучшее устройство элемента, при условии его неподвижности, основывается на гравитационном разделении растворов без какой-либо перегородки между ними. В таком элементе разбавленный раствор ZnSO4 осторожно заливают поверх концентрированного, более плотного раствора CuSO4. При неподвижном состоянии и отсутствии вибраций элемент работает очень хорошо. Внутреннее сопротивление таком элементе почти полностью отсутствует, и это дает возможность получать большие токи. Такой элемент Даниэля раньше широко использовался в качестве стационарного источника тока на телеграфных станциях и в домах для дверных звонков. Подобный элемент можно сделать и другим способом. Стеклянная банка заливается концентрированным растворов поваренной соли (NaCl). У дна банки размещается медный электрод, а наверху цинковый. На дно банки аккуратно опускаются кристаллы CuSO4. Сульфат меди, растворяясь на дне, с концентрированным раствором NaCl смешивается медленно, из-за этого ионы Cu2+ не достигают цинкового электрода.

Медно-цинковый гальванический элемент в одной банке без перегородок
Как мы видим, для того, чтобы электроны могли совершить полезную работу, нужно заставить их двигаться по внешней цепи.
В принципе, любой окислительно-восстановительный процесс может дать свой гальванический элемент. Ведь каждая пара характеризуется своим окислительно-восстановительным потенциалом. Выбираем две такие пары, располагаем их как электроды, соединяем соответствующим образом и элемент готов. Он будет работать. Есть только одна трудность - как сделать электрод. С металлами это не сложно. Погружаем их в раствор их же соли, и электрод сконструирован. С некоторыми газами это также оказывается делом возможным. Но существует много других окислительно-восстановительных процессов, при которых конструирование соответствующих электродов совсем не просто.
Не знаю, обратили ли Вы достаточное внимание на то обстоятельство, что электродный потенциал (по уравнениям Нернста и Петерса) в немалой степени зависит от концентрации ионов в растворе. Не можем ли мы и из этого извлечь пользу? Раз электродный потенциал зависит от концентрации, то при погружении одного и того же металла в растворы его ионов различной концентрации можно получать различный электродный потенциал. Из таких электродов можно сделать и гальванический элемент. Называют его концентрационный гальванический элемент. Берем, например, две медные пластинки и погружаем их в растворы с концентрацией медных солей соответственно 2 моль/л и 0,2 моль/л (в расчете на ион меди). Ставим электролитный мост. Соединяем электроды проводником. Элемент начинает работать. На одном электроде, там, где концентрация ионов меди в растворе ниже, происходит непрерывное растворение меди:
Cu - 2е- → Cu2+
При этом медь окисляется, концентрация ионов меди в растворе постоянно повышается. На другом электроде совершается обратный переход - ионы меди из раствора осаждаются на поверхность металла:
Cu2+ + 2е- → Cu
Ионы меди восстанавливаются, их концентрация в растворе непрерывно уменьшается. Итак, концентрационный гальванический элемент работает за счет разности концентрации ионов меди у обоих электродов, пока концентрации ионов у двух электродов не станут равными. Тогда исчезнет и разность электродных потенциалов, следовательно, не будет и напряжения. Можно добавить к одному из двух растворов воду, чтобы изменилась концентрация соли. Опять возникнет разность электродных потенциалов, и гальванический элемент снова заработает. Можно даже поменять знаки у электродов. Концентрационные гальванические элементы редко используются на практике, поскольку при их изготовлении как из различных, так и одинаковых окислительно-восстановительных пар (при различной концентрации соответствующих ионов в растворе), трудно учесть влияние, зависящего от концентрации, слагаемого в уравнении Нернста.
5) Портландцемент (англ. Portlandcement) — гидравлическое вяжущее вещество, в составе которого преобладают силикаты кальция (70-80 %). Это вид цемента, наиболее широко применяемый во всех странах.
Название получил по имени острова Портленд (Portland) в Англии, так как по цвету похож на добываемый там природный камень.
Основой портландцемента являются силикаты кальция (алит и белит).
Портландцемент получают тонким измельчением клинкера и гипса. Клинкер — продукт равномерного обжига до спекания однородной сырьевой смеси, состоящей из известняка и глины определённого состава, обеспечивающего преобладание силикатов кальция (3СаО∙SiO2 и 2СаО∙SiO2 70-80 %).
Самые распространённые методы производства портландцемента так называемые «сухой» и «мокрый». Всё зависит от того, каким способом смешивается сырьевая смесь — в виде водных растворов или в виде сухих смесей.
При измельчении клинкера вводят добавки: 1,5…3,5 % гипса СaSO4∙2H2O (в перерасчёте на ангидрид серной кислоты SO3) для регулирования сроков схватывания, до 15 % активных минеральных добавок — для улучшения некоторых свойств и снижения стоимости цемента.
Сырьём для производства портландцемента служат смеси, состоящие из 75…78 % известняка (мела, ракушечника, известнякового туфа, мрамора) и 22…25 % глин (глинистых сланцев, суглинков), либо известняковые мергели, использование которых упрощает технологию. Для получения требуемого химического состава сырья используют корректирующие добавки: пиритные огарки, колошниковую пыль, бокситы, пески, опоки, трепелы.
При мокром способе производства уменьшается расход электроэнергии на измельчение сырьевых материалов, облегчается транспортирование и перемешивание сырьевой смеси, выше гомогенность шлама и качество цемента, однако расход топлива на обжиг и сушку составляет на 30-40 % больше чем при сухом способе.
Обжиг сырьевой смеси проводится при температуре 1 470°C в течение 2…4 часов в длинных вращающихся печах (3,6х127 м, 4×150 м и 4,5х170 м) с внутренними теплообменными устройствами, для упрощения синтеза необходимых минералов цементного клинкера. В обжигаемом материале происходят сложные физико-химические процессы. Вращающуюся печь мокрого способа условно можно поделить на зоны:
§ сушки (температура материала 100…200 °C — здесь происходит частичное испарение воды);
§ подогрева (200…650 °C — выгорают органические примеси и начинаются процессы дегидратации и разложения глинистого компонента). Например, разложение каолинита происходит по следующей формуле: Al2O3∙2SiO2∙2H2O → Al2O3∙2SiO2 + 2H2O; далее при температурах 600…1 000 °C происходит распад алюмосиликатов на оксиды и метапродукты.
§ декарбонизации (900…1 200 °C) происходит декарбонизация известнякового компонента: СаСО3 → СаО + СО2, одновременно продолжается распад глинистых минералов на оксиды. В результате взаимодействия основных (СаО, MgO) и кислотных оксидов (Al2O3, SiO2) в этой же зоне начинаются процессы твердофазового синтеза новых соединений (СаО∙ Al2O3 — сокращённая запись СА, который при более высоких температурах реагирует с СаО и в конце жидкофазового синтеза образуется С3А), протекающих ступенчато;
§ экзотермических реакций (1 200…1 350 °C) завершется процесс твёрдофазового спекания материалов, здесь полностью завершается процесс образования таких минералов как С3А, С4АF (F — Fe2O3) и C2S (S — SiO2) — 3 из 4 основных минералов клинкера;
§ спекания (1 300→1 470→1 300 °C) частичное плавление материала, в расплав переходят клинкерные минералы кроме C2S, который взаимодействуя с оставшимся в расплаве СаО образует минерал АЛИТ (С3S);
§ охлаждения (1 300…1 000 °C) температура понижается медленно. Часть жидкой фазы кристаллизуется с выделением кристаллов клинкерных минералов, а часть застывает в виде стекла.
Узнать данный вид цемента можно по внешнему виду — это зеленовато-серый порошок. Как и все цементы, если к нему добавить воду, он при высыхании принимает камнеобразное состояние и не имеет существенных отличий по своему составу и физико-химическим свойствам от обычного цемента.
Существуют следующие виды портландцемента:
§ быстротвердеющий;
§ пластифицированный;
§ гидрофобный;
§ сульфатостойкий;
§ дорожный;
§ белый и цветной;
§ с умеренной экзотермией;
§ с поверхностноактивными органическими добавками.
 2018-01-21
2018-01-21 4455
4455