Билет №1
Билет №2
Билет №3
Билет №4
Билет №5.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
Физико-химическая теория растворов, энергетика процесса растворения. Механизм растворения.
Понятие об электролизе. Сходство и различие процессов в гальванических элементах и при электролизе.
Ответ:
Растворы гомогенные системы, состоящие из двух или более компонентов, состав которых можно изменять в некоторых пределах без нарушения однородности (твердые, жидкие, газообразные).
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твердых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многиефизические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
Растворение - сложный физико-химический процесс. Растворение – самопроизвольный процесс (DG < 0).
| фазовый переход DНф.п. > 0, DSф.п. > 0 | сольватация DHсольв. < 0, DSсольв. < 0 |
DH = DHф.п. + DHсольв.
DS = DSф.п. + DSсольв.
Электролиз – окислительно-восстановительные процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника.
При рассматривании ГЭ мы говорили, что на электродах самопроизвольно (из-за разности Е0) протекают Ox-Red реакции причем Ox и Red разделены в пространстве. Освободившиеся в реакции окисления электроны переходят в зону восстановления через внешнюю цепь. Так, в ГЭ Pt, H2/H2SO4/O2, Pt
А(-) H2 → 2H+ + 2 e (окисление)
К(+) ½O2 + 2H+ + 2 e → H2O (восстановление)
――――――――――――――
H2 + ½O2 → H2O
Этот процесс происходит в ГЭ самопроизвольно ∆G0р-ции = -237,3 кДж/моль.
Поэтому поток электронов перемещается во внешней цепи и обуславливает взаимосвязь полуреакций окисления и восстановления.
Если с помощью внешнего источника тока обеспечить обратное протекание электронов, тогда они, поступая к водородному электроду, примут участие в процессе восстановления, а на другом электроде пойдет процесс окисления:
К(-) 2H+ + 2 e → H2
A(+) H2O → ½O2 + 2H+ + 2 e
―――――――――――――
H2O → H2 + ½O2
Для этого процесса ∆G0р-ции = 237,3 > 0 следовательно, при стандартных условиях самопроизвольно не идет.
Т. о. при электролизе реакции электродов в отличие от ГЭ поменялись: водородный – К(-), кислородный А(+), что обусловлено обратным направлением тока.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
1. Способы выражения концентрации растворов.
2. Скорость химической реакции: средняя и истинная. Зависимость скорости химической реакции от концентрации реагентов. Закон действующих масс для простых гомогенных и гетерогенных реакций.
Ответ:
Концентрация раствора.
Молярная концентрация (С) – число молей растворенного вещества в одном литре раствора.
 |
Моляльная концентрация (Сm) – число молей растворенного вещества в одном килограмме растворителя.
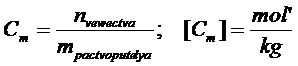
 Процентная концентрация (ω) – число граммов растворенного вещества в 100 граммах раствора.
Процентная концентрация (ω) – число граммов растворенного вещества в 100 граммах раствора.
Скорость реакции.
 Скорость реакции изменение концентрации реагентов или продуктов реакции в единицу времени
Скорость реакции изменение концентрации реагентов или продуктов реакции в единицу времени
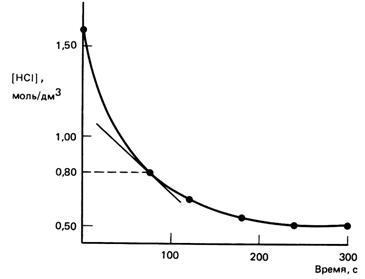
Средняя скорость – конечное изменение концентрации с2-с1, относящееся к промежутку времени t2-t1
Истинная (мгновенная) скорость – первая производная концентрации по времени

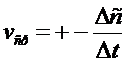
Скорость реакции зависит:
• от природы реагирующих веществ
• от температуры
• от концентрации
• от давления (для газов)
• от катализатора
• от площади соприкосновения (для гетерогенных реакций)
• от среды (для реакций в растворах)
• от формы сосуда (для цепных реакций)
 2018-01-21
2018-01-21 550
550







