Кислородсодержащие кислоты хлора: НСlO4 – хлорная; НСlO3 – хлорноватая; НСlO2 – хлористая хлориты; НСlO – хлорноватистая. Кислородсодержащие кислоты хлора существуют в водном растворе преимущественно в молекулярной форме.
Одна из важнейших и широко используемых кислот HClO4 (хлорная) – весьма подвижная, сильно дымящая на воздухе жидкость. При хранении и нагревании до 365 К кислота сначала окрашивается в коричнево-красный цвет, а затем взрывается. Водные растворы HClO4 устойчивы при хранении и безопасны в обращении
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления: НСlO> НСlO2> НСlO3> НСlO4
1) окисляет ионы железа (II) до ионов железа (III).
2) на солнечном свету разлагается с образованием кислорода.
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат.
Соли кислородсодержащих кислот хлора - обычно более устойчивы, чем сами кислоты. В растворах окислительная способность кислородсодержащих солей хлора тем больше, чем больше в этих солях степень окисления хлора. Натриевые и калиевые соли имеют важное промышленное значение. Хлорат (V) калия обычно используют для лабораторного получения кислорода.
Получение: Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4:
2ClO2 + H2O2 = 2HClO2 + O2
С кислородом галогены непосредственно не взаимодействуют, а озон превращает галогены (Cl) в оксиды разного состава в зависимости от условий осуществления реакций. Оксиды хлора – эндотермические соединения. Они легко взрываются, окисляют другие вещества и характеризуются крайней неустойчивостью.
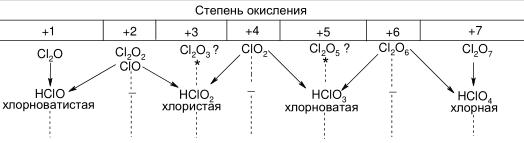
Звездочки означают, что данные оксиды при смешении с водой не дают кислот. Из схемы видно, что оксиды с нечетной степенью окисления образуют одну кислоту, а оксиды с четной степенью окисления – две кислоты, т. к. протекает реакция диспропор -ционирования. Для галогенов характерны нечетные степени окисления.
При нагревании все оксиды галогенов разлагаются на галоген и O2.
При взаимодействии Cl2O, Cl2O7 с водными растворами KOH и Ca(OH)2 образуются соли соответствующих кислородных кислот галогенов, например:
Cl 2 O + Ca (OH)2 = Ca (ClO)2 + H 2 O
 2018-01-21
2018-01-21 3415
3415








