Основные газовые законы. Определение молекулярных масс газообразных веществ.
К основному газовому закону относится уравнение состояния газа (уравнение Менделеева-Клапейрона): 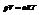
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится  При нормальных условиях моль газа занимает 22,4 л.
При нормальных условиях моль газа занимает 22,4 л.
Универсальный газовый закон.

При изобарном процессе 

При изохорном процессе 

При изотермическом процессе 
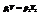
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Масса газообразных веществ определяется по закону Авогадро и уравнению Менделеева-Клапейрона.
Основные стехиометрические законы.
1. Закон постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. Закон эквивалентов: в-ва вступают в химическое взаимодействие и замещают друг друга в соединениях в весовых количествах ропорциональным химическим эквивалентам этих веществ.
Химический эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. Закон простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа.
Пример. H20/H2O2, CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. Закон сохранения массы и энергии: в изолированной системе сумма масс и энергий постоянна.
5. Закон Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится 
 2018-01-21
2018-01-21 877
877







