Рассмотрим гомогенную химическую реакцию: 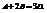 Реакции протекают до полного исчезновения исходных веществ, а останавливаются при достижении определенного состояния равновесия. Условия химического равновесия:
Реакции протекают до полного исчезновения исходных веществ, а останавливаются при достижении определенного состояния равновесия. Условия химического равновесия: 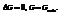
Равновесные давления участников реакции:  Согласно закону действующих масс
Согласно закону действующих масс 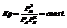
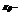 константа равновесия, выраженная через парциальные давления. Размерность
константа равновесия, выраженная через парциальные давления. Размерность  .
. 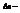 изменение числа молей при протекании реакции.
изменение числа молей при протекании реакции.
При написании констант равновесия гетерогенных реакции учитываются парциальные давления только газообразных участников реакций, поскольку давления пара конденсированных фаз малы по сравнению с газообразными компонентами.
Пример. 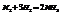

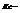 константа равновесия, выраженная через концентрации.
константа равновесия, выраженная через концентрации.

Кроме того существуют  где а-активности, н-мольная доля.
где а-активности, н-мольная доля.
Соотношения между константами равновесия:
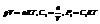

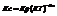
Принцип Ле-Шателье.
При неизменных условиях химическое равновесие в системе может сохраняться сколь угодно долго. В случае же изменения условий (концентрация, температура, давление) одна из противоположно направленных реакций может ускориться, чем другая. После этого равновесие сместится, и установится новое состояние равновесия.
|
|
|
Принцип Ле-Шателье: если на систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия.
Влияние температуры.
Повышение температуры смещает равновесие в сторону процесса, идущего с поглощением тепла.

 2018-01-21
2018-01-21 1292
1292








