Электрохимия – область физической химии, охватывающая химические процессы, сопровождающиеся возникновением электрического тока, либо вызванные действием электрического тока.
Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. В объеме металла устанавливается подвижное равновесие: Ме=Men++ n*ē. При погружении электрода в воду катионы металла гидратируются полярными молекулами воды и переходят в раствор, Men++ mH2O=Meрn+m*H2O.
Поверхность электрода заряжается отрицательно за счет оставшихся электронов, из-за этого перешедшие в раствор катионы не могут отойти от электрода. Катионы и электроны создают двойной электрический слой (его толщина зависит от концентрации раствора, температуры, заряда металла). Пограничный слой жидкости заряжается положительно, поверхность металла отрицательно, возникает скачок электрического потенциала – электродный потенциал.
Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения – равновесный потенциал.
|
|
|
Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости – положительно.
Данный скачок можно охарактеризовать реакцией: 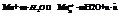
Рассмотрим погружение в раствор активного и неактивного металла.
1. Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.
2. Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя.
 2018-01-21
2018-01-21 843
843








