РАСТВОРЫ, гомогенные системы, состоящие из двух или более компонентов, состав к-рых в определенных пределах может непрерывно изменяться. От мех. смесей растворы отличаются своей однородностью и возрастанием энтропии системы при смешении компонентов. По агрегатному состоянию различают растворы газовые (газовые смеси), жидкие и твердые. Обычно, если особо не оговаривается, термин "растворы" относят к жидким системам; см. также Твердые растворы.
Относит. содержание компонента в растворе характеризуется его концентрацией. При этом преобладающий компонент обычно называют растворителем, остальные компоненты-растворенными веществами; такое деление, однако, является условным. При определенных т-ре и давлении растворение одного компонента в другом происходит в нек-рых пределах изменения концентрации, т.е. смешение является ограниченным. Равновесный раствор, в к-ром при ограниченной р-римости компонентов и заданных внеш. условиях концентрация одного из компонентов максимальна, наз. насыщенным, а его концентрация наз. растворимостью компонента. Зависимость р-римости от т-ры и давления обычно изображают графически в виде диаграмм р-римости (см. Диаграмма состояния, Растворимость). При концентрациях растворенного в-ва, меньших его р-римости, растворы наз. ненасыщенным. Раствор, переохлажденный таким образом, что концентрация растворенного в-ва превышает его р-римость, наз. пересыщенным. Пересыщенные растворы мета-стабильны, при внесении затравки или перемешивании возможно самопроизвольное выделение избытка пересыщающего компонента, что ведет к образованию новой жидкой или твердой фазы (см. Зарождение новой фазы).
По наличию или отсутствию электролитической диссоциации молекул растворенных в-в различают два осн. класса растворов: растворы электролитов и растворы неэлектролитов. В особый класс выделяют также растворы высокомол. соединений, св-ва к-рых существенно отличаются от св-в растворов низкомол. в-в из-за больших различий в размерах молекул растворенного в-ва и р-рителя (см. Растворы полимеров). Классификация растворов может быть основана также и на др. признаках. Так, в зависимости от концентрации растворенного в-ва различают растворы концентрированные и разбавленные; в зависимости от природы р-рителя выделяют водные и неводные растворы; в зависимости от концентрации ионов Н+ и ОН- - кислые, нейтральные и щелочные (основные).
Термодинамич. св-ва растворов определяются взаимод. между молекулами компонентов и характеризуют растворы в целом. Доля, вносимая данным компонентом в то или иное св-во раствора, определяется парциальной молярной величиной компонента. Особое значение имеет парциальная молярная энергия Гиббса - химический потенциал компонента, к-рый позволяет выражать условия фазового и хим. равновесий в растворах. Важнейшее св-во растворов-зависимость хим. потенциалов компонентов от состава.
Межмол. взаимод. и тепловое движение приводят к образованию флуктуации концентрации - короткоживущих группировок молекул, обусловливающих отклонение локального микроскопич. состава раствора от макроскопического. Если компоненты близки по хим. строению, размерам и характеру взаимод., структура раствора принципиально не отличается от строения чистых жидкостей. При наличии специфич. взаимод. (хим. превращений, водородных связей и т. п.) растворенные в-ва могут образовывать устойчивые комплексы с р-рителем как постоянного, так и переменного состава (см. Сольватация). В ряде растворов взаимод. молекул растворенного в-ва с молекулами р-рителя сопровождается противоположным процессом - диссоциацией молекул растворенного в-ва.
При малых концентрациях растворенных в-в в растворах сохраняется структура, характерная для чистого р-рителя, с увеличением концентрации структура растворов изменяется. Напр., у водных растворов электролитов ионы больших размеров (в сравнении с молекулой воды) разрушают структуру р-рителя, а ионы меньших размеров ее упорядочивают. Установление связи св-в растворов с характером межмол. взаимод. или макро-скопич. св-вами чистых компонентов составляет проблему теории растворов.
Растворы широко распространены в природе и играют важную роль во мн. отраслях пром-сти и техники. Химически чистые в-ва представляют собой лишь предельное состояние, к-рое в действительности не достигается; даже чистейшие металлы, получаемые методами вакуумной или зонной плавки, содержат ничтожные кол-ва примесей (10-6 %) и по существу являются твердыми растворами. Образование растворов существенно изменяет условия протекания хим. р-ций между компонентами (см. Реакции в растворах); мн. процессы происходят исключительно в растворах. Изучение физ.-хим. св-в растворов тесно связано с проблемами разделения прир. и пром. смесей, получения чистых в-в методами ректификации, экстракции, кристаллизации, абсорбции и др. Водные растворы солей, к-т и оснований широко используют в гидрометаллургии при извлечении цветных металлов из руд. Исключительна роль водных растворов во всех биол. процессах. Использование неводных растворов связано с применением полимеров, красителей, лаков, приготовлением жидкостей с заданными физ. св-вами (вязкостью, диэлектрич. проницаемостью и др.).
Способы выражения концентрации растворов
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель - через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля - это отношение массы растворенного ве
щества к общей массе раствора. Для бинарного раствора:
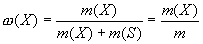 (1)
(1)
где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
С(Х) = v(Х) / V, (2)
где С(Х) - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2МNаОН.
Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
 (3)
(3)
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) - количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
N(X) + N(S) = 1. (4)
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) - массовая доля растворенного вещества, выраженная в %; М(Х) - молярная масса растворенного вещества, г/моль; р = m/(1000 V) - плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просто растворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
ks = mв-ва / mр-ля. (7)
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
s = (mв-ва / mр-ля) ∙ 100. (8)
Массовая доля вещества
Массовая доля обозначается греческой буквой "омега" и равна отношению массы растворенного вещества к общей массе раствора
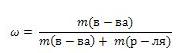
Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%).
Молярная концентрация (молярность)
показывает, сколько моль вещества содержится в 1 литре (1000 мл.) раствора. Обозначается См. Единица измерения - [моль/л] (часто пишут просто М)
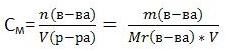 ,
,
где n - количество вещества в молях, V - объём раствора, m - масса вещества, Mr - молярная масса вещества.
Моляльная концентрация (моляльность)
число молей растворенного вещества в 1 килограмме (1000 г.) расторителя. Единица измерения - [моль/кг]
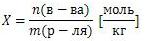
Нормальная концентрация (нормальность)
это число эквивалентов в 1 литре раствора. Обозначают символом Сн
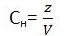
0,1 нормальный раствор - децинормальный.
Титр
количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH)
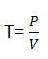 ,
,
где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы.
Растворимость, способность вещества образовывать с другим веществом (или веществами) гомогенные смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают вещество, которое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор. Если до растворения оба вещества находились в одном и том же агрегатном состоянии, растворителем считается вещество, присутствующее в смеси в существенно большем кол-ве.
Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодействием однородных и разнородных компонентов раствора. Как правило, хорошо растворимы друг в друге подобные по физ. и хим. свойствам вещества (эмпирич. правило "подобное растворяется в подобном"). В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо раств. в полярных растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо раств. в неполярных растворителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная растворимость неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V)1/2, где Е-теплота испарения, V-полярный объем. Параметр растворимости - одно из осн. понятий, определяющих когезионные свойства веществ в конденсир. состояниях; важная технол. характеристика полимеров и растворителей, лакокрасочных материалов и т.п. (см. Когезия). Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости растворителя. Обычно более растворимы электролиты с большей склонностью к сольватации растворителем; образование кристаллогидратов обычно увеличивает растворимость солей.
Растворимость данного вещества зависит от температуры и давления соответствует общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип). Концентрация насыщенного раствора при данных условиях численно определяет Р. вещества в данном растворителе и также наз. растворимостью. Пересыщенные растворы содержат большее кол-во растворенного вещества, чем это соответствует его растворимости, существование пересыщенных растворов обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы). Для характеристики растворимости малорастворимых веществ используют произведение активностей ПА (для растворов, близких по своим свойствам к идеальному - произведение растворимости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом температуры Р. газов в воде уменьшается. В орг. растворителях газы часто раств. с поглощением тепла и с ростом температуры растворимость газов повышается. В некоторых случаях на кривых зависимости растворимости газов от температуры наблюдается минимум (напр., система водород-вода). При постоянной температуре в случае образования идеального разбавленного бинарного раствора неэлектролита растворимость газа (молярная доля в растворе) пропорциональна его парциальному давлению над раствором (см. Генри закон). С ростом давления для определения Р. газа необходимо учитывать отклонение его свойств от свойств идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость - жидкость (жидкие смеси) различаются по следующим типам: жидкости смешиваются друг с другом во всех отношениях (напр., система вода - этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом температуры взаимная Р. жидкостей в большинстве случаев увеличивается и, если не достигается температура кипения, существует температура, при которой обе жидкости смешиваются друг с другом в любых соотношениях, - так называемая критическая температура растворимости, или верхняя критическая точка смешения (ВКТС). Если достигается температура кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В некоторых системах взаимная растворимость повышается с понижением температуры и возможно достижение нижней критической температуры смешения (HKTС). Известны системы (напр., вода-трибутилфосфиноксид), где имеется и верхняя и нижняя критические точки (см. Критическое состояние). Обычно область расслаивания жидкой смеси при понижении температуры пересекается с линией ликвидуса с образованием монотектич. или синтектич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на растворимость зависит от того, как изменяется с давлением молярный объем вещества и его парциальный молярный объем в растворе. Если при некотором давлении молярный объем вещества становится меньше его парциального молярного объема, растворимость вещества с ростом давления снижается. Такая закономерность характерна для неполярных растворителей; например, растворимость гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости растворимости от давления имеется максимум. Для электролитов на зависимость растворимости от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами растворителя. Взаимная растворимость жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
Вещество, способное растворяться в двух неограниченно смешивающихся друг с другом растворителях, распределяется между ними так, что отношение его активностей в этих растворителях а1 и а2 при постоянной температуре остается постоянным, независимо от общего кол-ва растворенного вещества: a1/a2 = К, где К - коэффициент распределения (закон Бертло-Нернста). Для сильно разбавленных растворов вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение температуры приводит к увеличению растворимости Если образуется идеальный раствор, зависимость растворимости от температуры записывается уравнением Шредера
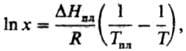
где DHпл и Тпл – энтальпия плавления и температура плавления растворенного вещества. Если энергия сольватации больше энергии, необходимой для разрушения кристаллической решетки, растворение является экзотермическим процессом и растворимость с ростом температуры понижается. У некоторых веществ (напр., гипс) наблюдается минимум на кривой зависимости растворимости от температуры. При образовании твердых растворов максимум растворимости достигается, как правило, при температуре трехфазного равновесия - эвтектического или перитектического. Но в некоторых системах максимум растворимость отвечает более высокой температуре (системы с ретроградной растворимостью).
Растворимость изучают изотермическими или политермическими методами (см. Термический анализ). Полученные результаты представляют в виде диаграмм расвторимости, которые являются частным случаем диаграммы состояния. Объемное изображение фазовых состояний системы в пространстве параметров состояния (температуры и составов различных фаз) сводят специальными приемами к фигурам на плоскости. Для тройной системы из двух солей и воды используют обычный концентрационный треугольник, вершины которого отвечают чистым компонентам (см. Многокомпонентные системы). Применяют также изображение растворимости по способу Шрейнемакерса (Ф. Схрейнемакерс), при котором вершина прямоугольной системы координат отвечает чистой воде, а по обеим осям откладывают концентрации солей, выраженные кол-вом той или другой соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат в бесконечности (см. рис. а). Др. прием построения диаграмм растворимости на плоскости - способ Йенеке (см. рис. б): на оси абсцисс отражается состав солевой массы раствора, т.е. соотношение концентраций солей, а по оси ординат откладывается кол-во воды на определенное кол-во растворенных веществ (напр., 1 моль). В этом способе в бесконечности находится точка, отвечающая чистой воде. На диаграммах (см. рис. а и б) буквой Ж обозначено фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных растворов, Ж + А + В - тройная пересыщенная система; линии А'E отвечают растворам, насыщ. компонентом А (концентрация насыщения при данном содержании В), линии ЕB'-р-рам, насыщенным компонентом В, Е-эвтонич. точка системы (эвтоника), отвечающая составу раствора, насыщенного двумя компонентами (аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс. концентрацией растворенных веществ в растворе, миним. парциальным давлением пара растворителя над раствором, постоянством состава раствора и давления пара при изотермич. испарении вплоть до окончат. высыхания системы.
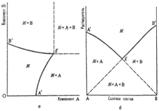
Изотермическая диаграмма растворимости тройной системы соль А - соль В - вода с изображением по способу Шрейнемакерса (а) и по способу Йенеке (б). Пояснения в тексте.
Использование диаграмм расвторимости позволяет установить сосуществующие фазы при данной температуре и соответствующие им составы растворов, провести расчеты процессов испарения, кристаллизации из растворов и т. п., что необходимо для обоснования многих технологических схем. Например, диаграмма растворимости системы KCl-NaCl-H2O является основой технологии переработки сильвинитов, системы K2SO4-MgCl2-H2O-переработки полиминеральных галургических руд.
Билет 20.
 2018-01-21
2018-01-21 2461
2461
