РАУЛЯ ЗАКОН: относит. понижение парциального давления пара растворитсля над разб. бинарным раствором неэлектролита равно молярной доле растворенного вещества x в:
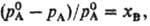
где рА- парциальное давление растворителя,  -давление на-сыщ. пара чистого растворителя. Соотв. для молярной доли растворителя x A можно записать:
-давление на-сыщ. пара чистого растворителя. Соотв. для молярной доли растворителя x A можно записать:
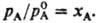
Если пар над раствором нельзя считать идеальным газом. давления  и рА заменяют на фугитивности f А и
и рА заменяют на фугитивности f А и  :
:

Р-ры, для которых Р. з. выполняется во всем интервале концентраций для обоих компонентов, наз. идеальными (совершенными). Для идеального раствора термодинамич. активность компонента a А равна его молярной доле х А (а А = = x А), а хим. потенциал компонента, по определению, равен:

где Т -абс. температура, R -газовая постоянная, 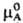 -стандартный хим. потенциал (см. Стандартное состояние). Парциальное давление растворенного вещества при постоянной температуре пропорционально его молярной доле (см. Генри закон), зависимость осмотич. давления раствора от концентрации растворенного вещества выражается законом Вант-Гоффа (см. Оcмос).
-стандартный хим. потенциал (см. Стандартное состояние). Парциальное давление растворенного вещества при постоянной температуре пропорционально его молярной доле (см. Генри закон), зависимость осмотич. давления раствора от концентрации растворенного вещества выражается законом Вант-Гоффа (см. Оcмос).
|
|
|
Положительные (а)и отрицательные (б)отклонения раствора от идеальности. На оси абсцисс отложена молярная доля растворителя (компонент А), по оси ординат-парциальное давление растворенного вещества (компонент В). Пунктиром показаны соответствующие зависимости для идеального раствора.

Для мн. бинарных систем-жидких и твердых растворов, расплавов, многокомпонентных смесей - Р. з. выполняется с достаточной точностью и служит хорошим приближением для определения парциальных давлений при молярной доле растворенного вещества до 0,1-0,5. Если парциальные давления компонентов выше значений, предсказываемых Р. з., говорят о положит. отклонениях от идеальности, если ниже-об отрицат. отклонениях. Для смесей орг. веществ типа С6Н6-(СН3)2СО, (С2Н5)2О-СНС13 отклонение от идеальности не превышает 100% (см. рис.). При сильном взаимод. компонентов, например в случае расплава KF-A1F3, парциальные давления компонентов м. б. ниже рассчитанных в соответствии с Р.з. на 5-10 порядков.
 2018-01-21
2018-01-21 493
493








