Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы. образующиеся в результате электролитической диссоциации молекул растворенного вещества. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Р. э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных растворы электролитов (т. е. свойства, зависящие только от концентрации растворенного вещества, но не от его природы) существенно отличаются от тех же свойств растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара растворителя над раствором в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворы электролитов, особенности теоретич. подходов в сравнении с др. классами растворов. Наиб. изучены водные растворы электролитов, играющие важную роль во многих биол., геол. и техн. процессах. Неводные растворы электролитов служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения веществ и др.).
|
|
|
Классификация растворы электролитов основана на классификации электролитов. Соответственно о растворы электролитов говорят как о симметричных и несимметричных в зависимости от того, распадается ли молекула растворенного вещества в растворе на два иона или на большее число частиц; z, z -зарядных [напр., раствор NaCl 1,1-зарядный, раствор СаС12 2,1-зарядный] и т.п.-По степени диссоциации электролита a, которая равна отношению числа молекул, диссоциированных на ионы, к полному числу молекул в растворс, различают сильные (a = 1), слабые (a << 1) электролиты и, соотв., растворы сильных и слабых электролитов. Такое деление, однако, является условным и отражает состояние электролита в растворе, определяемое не только природой растворенного вещества и растворителя, но и концентрацией (молярной долей х эл), т-рой Т, давлением р.
В зависимости от состояния растворенного вещества до растворения выделяют два класса растворы электролитов -р-ры ионофоров и растворы ионогенов. Ионофоры в чистом состоянии существуют в виде ионных кристаллов (напр., галогениды щелочных металлов). В сильнополярных растворителях (напр., в воде) ионофоры, как правило, диссоциируют полностью и составляют растворы сильных электролитов. В слабополярных растворителях (напр., в уксусной кислоте) они образуют растворы слабых электролитов. Ионогены до растворения состоят из молекул, они являются потенц. электролитами, электролитич. диссоциация проходит, как правило, в две стадии и обычно не полностью (хлорная кислота в уксусной кислоте).
|
|
|
Растворители для Р.э -как правило, полярные жидкости (чистые или смешанные). Чем больше диэлектрич. проницаемость e растворителя, тем значительнее ослабляется сильное электростатич. притяжение противоположно заряженных ионов, что способствует возникновению в растворе ионов. Интенсивное взаимод. последних с молекулами растворителя приводит к связыванию ионов с молекулами растворителя (см. Сольватация). Важна также способность молекул растворителя выступать в качестве доноров или акцепторов протонов или электронов. В зависимости от этих двух свойств различают четыре группы растворителей: 1) протонные растворители (вода, спирты. карбоновыс кислоты и др.), которые являются хорошими донорами протона и обладают высокой диэлектрич. проницаемостью (e > 15); 2) апротонные дшюлярные растворители (некоторые апротонные амиды, кстоны, сульфоксиды и др.), обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными свойствами в отношении протона; 3) электронодонорные-р-рители (напр., эфиры); 4) неполяр-ныс растворители (сероуглерод, углеводороды), которые обладают низкой диэлектрич. проницаемостью (e < 15) и не обладают донорно-акцепторными свойствами ни по отношению к протону, ни по отношению к электрону.
Находящиеся в растворы электролитов ионы могут существовать в виде своб. сольватир. ионов или в виде ассоциатов-контактных или сольватно разделенных ионных пар, тройников и т.д. Поскольку ионные пары не проводят электрич. ток, содержание своб. ионов в растворы электролитов определяется по его электрич. проводимости, в то время как общее число ионов (свободных и ассоциированных) можно определить, например, спектрофотомет-рич. методами.
Термодинамика растворы электролитов Равновесные тсрмодинамич. свойства растворы электролитов описываются парциальными молярными величинами, в которых различают катионные и анионные вклады. Напр., для электролита типа  , состоящего из z+ -валентных катионов Mz+ и z _-валентных анионов X-, хим. потенциал равен:
, состоящего из z+ -валентных катионов Mz+ и z _-валентных анионов X-, хим. потенциал равен:

где v = v ++ v _, x + и х-- молярные доли катионов и анионов соотв., средняя молярная доля электролита хb = = 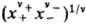 , g+ и g_ -коэффициенты активности катионов и анионов,
, g+ и g_ -коэффициенты активности катионов и анионов, 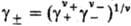 -средний коэф. активности электролита (см. Активность),
-средний коэф. активности электролита (см. Активность),  и
и 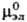 -стандартные хим. потенциалы катионов, анионов и электролита соотв., R -газовая постоянная.
-стандартные хим. потенциалы катионов, анионов и электролита соотв., R -газовая постоянная.
Др. парциальные молярные величины связаны с mэл термо-динамич. соотношениями: парциальная молярная энтропия S эл = -(9 mэл/ 9Т) p, парциальная молярная энтальпия H эд_= = -Т 2[(9 mэл/ Т)/ 9Т ] р, теплоемкость Ср = -Т (92 mэл/ 9Т 2) p, парциальный молярный объем V эл = (9 mэл/ 9р) T.
В качестве стандартного состояния компонентов в растворы электролитов выбирают: для растворителя-состояние чистой жидкости, для растворенного вещества-состояние в гипотетич. растворе, где его концентрация и активность равны единице, а термодинамич. свойства 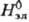 ,
,  ,
,  равны соответствующим значениям для бесконечно разб. раствора.
равны соответствующим значениям для бесконечно разб. раствора.
В электролитах с неполной степенью диссоциации (а < 1) выражение (1) заменяется соотношением:

где 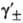 -средний ионный коэф. активности. Степень диссоциации а находят из условия хим. равновесия, которое в частном случае симметричного электролита (v+ =v_ = 1) приводит к ур-нию для константы диссоциации KD (или константы ассоциации Ка):
-средний ионный коэф. активности. Степень диссоциации а находят из условия хим. равновесия, которое в частном случае симметричного электролита (v+ =v_ = 1) приводит к ур-нию для константы диссоциации KD (или константы ассоциации Ка):

где 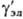 - коэф. активности недиссоциир. молекул (для разбавленных растворы электролитов
- коэф. активности недиссоциир. молекул (для разбавленных растворы электролитов 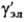 = 1). Аналогично (1) вводится также коэф. активности для растворителя g S, который связан с ионными коэф. активности Гиббса- Дюгема уравнением.
= 1). Аналогично (1) вводится также коэф. активности для растворителя g S, который связан с ионными коэф. активности Гиббса- Дюгема уравнением.
|
|
|
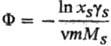
Для описания отклонения от идеального состояния разбавленных растворы электролитов используют кажущиеся осмотические коэффициенты, характеризующие отклонение осмотич. давления от значения, определяемого законом Вант-Гоффа, и связанные с ионными коэф. активности соотношением:

где m - моляльность электролита, gb-ионные коэф. активности в моляльной шкале, MS- молярная масса (кг·моль-1), xS- молярная доля растворителя.
Хим. потенциалы mэл, коэф. активности gb и осмотич. коэффициенты Ф м. б. определены экспериментально прямыми или косвенными методами: по давлению пара растворенного вещества или растворителя, по растворимости, по измерениям эдс электролитич. цепи. Из калориметрич. экспериментов находят парциальную молярную энтальпию H эл, а из измерений плотности-парциальные молярные объемы V эл. Поскольку измеримы только суммарные термодинамич. характеристики электролита, для катионов и анионов хим. потенциалы m + и m_, их стандартные значения  и
и  , коэф. активности g+ и g_ и связанные с ними парциальные молярные величины м. б. определены только приближенно, на основе нетер-модинамич. допущений (напр., о равенстве вкладов одинаковых по размерам и степеням окислений катионов и анионов), путем экстраполяции эксперим. данных для различных растворы электролитов с общим катионом или анионом и др.
, коэф. активности g+ и g_ и связанные с ними парциальные молярные величины м. б. определены только приближенно, на основе нетер-модинамич. допущений (напр., о равенстве вкладов одинаковых по размерам и степеням окислений катионов и анионов), путем экстраполяции эксперим. данных для различных растворы электролитов с общим катионом или анионом и др.
Наряду с хим. потенциалами ионов используют также электрохим. потенциал i -го иона с валентностью zi:

где F-Фарадея постоянная, f-внутр. электрич. потенциал растворы электролитов (см. Межфазные скачки потенциала).
Статистические теории растворы электролитов основаны на методах стати-стич. механики, их осн. задача-расчет свойств исходя из энергии межчастичного взаимодействия. Развиваются след. подходы: ионный подход (уровень Макмиллана-Майера); ион-но-молекулярный подход (уровень Борна-Оппенгеймера); электрон-ядерный подход (уровень Шрёдингера). Ионный подход является традиционным и к настоящему времени наиб. развит. Он основан на рассмотрении в явном виде только ионов, растворитель из явного рассмотрения исключается, что требует усреднения ф-ции распределения Гиббса по всем мол. конфигурациям растворителя (см. Статистическая термодинамика). Энергия межионного взаимод. представляется как сумма слагаемых унарного, бинарного, тернарного и т.д. типов. Унарные слагаемые выражаются через своб. энергию сольватации Wi i -го иона, характеризуемую изменением энергии Гиббса системы при переносе иона из идеальной газовой фазы в бесконечно разб. раствор. Значение Wi совпадает с неидеальной частью стандартного хим. потенциала i -го иона, причем выделяют электростатич., неэлект-ростатич. и хим. вклады в значение Wi. Электростатич. вклад Wiэл м. б. рассчитан согласно модели Борна, в рамках которой растворитель рассматривается как бесструктурная среда, характеризуемая диэлектрич. проницаемостью e:
|
|
|

где e0-диэлектрич. постоянная (диэлектрич. проницаемость вакуума), ri- ионный радиус (см. Атомные радиусы). Для уточнения расчета вместо радиуса ri используется эффективный радиус 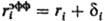 , где через d i учитываются размеры молекул растворителя. Предпринимаются попытки моделирования растворителя путем введения вместо e диэлектрич. ф-ции и учета нелинейных диэлектрич. эффектов.
, где через d i учитываются размеры молекул растворителя. Предпринимаются попытки моделирования растворителя путем введения вместо e диэлектрич. ф-ции и учета нелинейных диэлектрич. эффектов.
К неэлектростатич. вкладам в Wi относят индукционный и дисперсионный вклады (см. Дисперсионное взаимодействие), а также вклад, связанный с работой, которую необходимо затратить для образования в растворителе полости и внедрения в нее иона. Расчет этих вкладов производится теми же методами, что и для растворов неэлектролитов. Для расчета энергии сольватации применяют квантовохим. методы.
Бинарные слагаемые в энергии межионного взаимод. выражаются через потенциалы Wij (R), описывающие эффективное взаимод. ионов сортов i и j, находящихся на расстоянии R друг от друга. Соотв. тернарные слагаемые выражаются через потенциалы, описывающие трехчастичное взаимод. ионов и т. д. Учет бинарных и высших слагаемых в выражении для энергии межионного взаимод. позволяет описывать концентрац. зависимости термодинамич. свойств растворы электролитов
Св-ва растворы электролитов характеризуются сложными концентрац. зависимостями, обусловленными конкуренцией вкладов разл. типов межчастичных взаимодействий. Обычно ограничиваются учетом потенциалов парного взаимодействия. Его существ. особенность-кулоновский характер межионного взаимод. на больших расстояниях (при 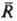 :,):
:,):
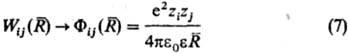
С кулоновским взаимод. связано экранирование межионных взаимод. и образование ионных комплексов, эти процессы характеризуются соотв. радиусом Дебая rD = 
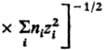 и радиусом Бьеррума
и радиусом Бьеррума  (k -пoстоянная Больцмана, ni -плотность ионов i -го сорта). Первый из них (rD) описывает расстояния, на которых экранируется поле иона за счет образования облака ионов противоположного знака, второй (rB)-расстояния, на которых кулоновское притяжение между катионом и анионом превышает среднюю энергию теплового движения, что приводит к образованию ионных пар. Эффекты экранирования кулоновских взаимод. учитываются Дебая - Хюккеля теорией; в этой теории первое приближение определяет ионные коэф. активности в области предельных разбавлений (ni: 0). Согласно теории Дебая - Хюккеля, коэф. активности ионов уменьшаются с концентрацией растворы электролитов Наличие в растворы электролитов ионных комплексов учитывается на основе представления о хим. равновесии между свободными и ассоциированными ионами, что приводит к ур-нию, аналогичному (3).
(k -пoстоянная Больцмана, ni -плотность ионов i -го сорта). Первый из них (rD) описывает расстояния, на которых экранируется поле иона за счет образования облака ионов противоположного знака, второй (rB)-расстояния, на которых кулоновское притяжение между катионом и анионом превышает среднюю энергию теплового движения, что приводит к образованию ионных пар. Эффекты экранирования кулоновских взаимод. учитываются Дебая - Хюккеля теорией; в этой теории первое приближение определяет ионные коэф. активности в области предельных разбавлений (ni: 0). Согласно теории Дебая - Хюккеля, коэф. активности ионов уменьшаются с концентрацией растворы электролитов Наличие в растворы электролитов ионных комплексов учитывается на основе представления о хим. равновесии между свободными и ассоциированными ионами, что приводит к ур-нию, аналогичному (3).
С увеличением концентрации электролита возникает необходимость учитывать и некулоновскую часть межионного взаимод., для чего прибегают к некоторым моделям. При этом наряду с индукционным, дисперсионным, обменным и др. видами межчастичных взаимод. некулоновский потенциал учитывает сольватац. эффекты, связанные с влиянием раствори-теля. В частности, учет некулоновской части взаимод. стабилизирует уменьшение коэф. активности ионов с концентрацией и может объяснить их увеличение, наблюдаемое экспериментально. Наипростейшей ионной моделью растворы электролитов является модель заряженных твердых сфер (т. наз. примитивная модель). Первые попытки описания примитивной модели были выполнены в рамках теории Дебая-Хюккеля (второе приближение). Более корректно учет размера ионов и неку-лоновского взаимод. осуществляется на основе методов статистич. термодинамики (см. Жидкость).
В рамках примитивной модели размеры ионов отличаются от кристаллографич. радиусов из-за сольватац. эффектов. Однако даже при одном и том же выборе размеров ионов удовлетворительно описать эксперим. результаты для разл. термодинамич. свойств растворы электролитов в примитивной модели оказалось затруднительным. К более корректным результатам приводит модель парного взаимод. типа "прямоугольной ямы", в которой ширина потенц. ямы выбирается равной диаметру молекулы растворителя, а глубина ямы считается подгоночным параметром, учитывающим сольватац. эффекты; при этом используются кристаллографич. размеры ионов. В более реалистич. модели Фридмана в некулонов-ском потенциале межионного взаимод. выделяют три слагаемых, соответствующих: 1) главному отталкиванию ионов, определяемому их кристаллографич. размерами; 2) эффекту поляризации полости ионов растворителем; 3) потенциалу Гер-ни-Франка, описывающему структурные эффекты, связанные с перекрыванием сольватных оболочек ионов при их сближении. Расчеты на основе ион-молекулярных моделей показывают, что на малых расстояниях межионные потенциалы имеют отталкивательный характер, на больших расстояниях, в соответствии с (7), зависят от расстояния между ионами асимптотически, как и при кулоновском взаимод., на промежут. расстояниях осциллируют вблизи этой асимптоты, причем с уменьшением размера иона (или с увеличением его валентности) амплитуда осцилляции возрастает, что соответствует усилению роли сольватац. эффектов.
Пренебрежение трехчастичными (и высшими) межионными взаимод. ограничивает возможности ионного подхода. В частности, для 1,1-зарядных водных растворы электролитов ионный подход обеспечивает количеств. описание термодинамич. свойств в области концентраций до 1 М. Учет концентрац. зависимости диэлектрич. проницаемости позволяет немного расширить эту концентрац. область. Формально расширения области применимости ионного подхода можно достигнуть, дополняя полученные с его помощью результаты разл. эмпирич. поправками. Примером такого подхода может служить полуэмпирич. ур-ние Питцера для осмотич. коэффициента или метод Робинсона-Стокса описания ионных коэф. активности с учетом гидратации (с помощью гидра-тац. чисел). Для описания многокомпонентных растворы электролитов широко используется правило Здановского, основанное на предположении о том, что смешение изописстич. растворов разл. электролитов, химически не взаимодействующих между собой, происходит без изменения активности растворителя.
Ионно-молекулярный подход основан на рассмотрении в явном виде как ионов, так и молекул растворителя. Главные результаты получены в 70-80-х гг. 20 в. на базе расчетных методов, интенсивно развиваемых в теории жидкостей. Это в осн. метод интегральных ур-ний для корреляц. ф-ций, метод кластерных разложений, теория возмущений, а также компьютерное моделирование. Благодаря явному учету ионно-молекулярных и межмолекулярных взаимод. возможно описание не только термодинамич., но и структурных свойств растворы электролитов В частности, важный результат - описание сольватации ионов в зависимости от концентрации и др. параметров раствора, объяснение концентрационных, температурных и барич. зависимостей свойств в широких интервалах состава, температуры и давления.
Наипростейшей ион-молекулярной моделью растворы электролитов является ион-дипольная модель, в которой ионы рассматриваются как заряженные твердые сферы, а молекулы растворителя моделируются твердыми сферами с дипольным моментом. Полученные выражения для термодинамич. ф-ций обобщают ур-ния, используемые в ионном подходе. В частности, в предельном случае малых концентраций выражения для ионных коэф. активности включают члены, основанные на теории Дебая-Хюккеля, а выражения для энергии сольватации-борновскую ф-лу (6) с эффективным радиусом иона 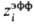 , в котором поправка d i в явном виде зависит от диэлектрич. проницаемости растворителя и соотношения размеров иона и молекулы. Выражение для диэлектрич. проницаемости удовлетворительно описывает эффект ее уменьшения при увеличении концентрации ионов.
, в котором поправка d i в явном виде зависит от диэлектрич. проницаемости растворителя и соотношения размеров иона и молекулы. Выражение для диэлектрич. проницаемости удовлетворительно описывает эффект ее уменьшения при увеличении концентрации ионов.
Предпринимаются попытки учета квадрупольного элект-рич. момента и поляризуемости молекул растворителя, а также взаимод., ответственных за образование в растворы электролитов ассоциатов и сольватов. Наиб. реальные модели разработаны в осн. для водных растворы электролитов и базируются обычно на компьютерном моделировании. Для описания ионно-молекулярных и межмолекулярных взаимод. применяют эмпирич. модели воды (модель ST 2, модель центр. сил и др.), а также модели, основанные на квантовохим. расчетах. Рассчитанные парциальные радиальные ф-ции распределения дают информацию о структуре раствора. В частности, с помощью ионно-молекулярных ф-ций определяют координац. числа сольватации. Найденные с помощью парциальных радиальных ф-ций структурные факторы удовлетворительно согласуются с данными дифракц. измерений.
Электрон-ядерный подход основан на учете электроста-тич. взаимод. между электронами и ядрами, входящими в состав ионов и молекул в растворы электролитов Этот подход является наиб. последовательным, он основан на квантовомех. рассмотрении и разработан пока лишь для ион-молекулярных комплексов.
Важное значение в физ. химии растворы электролитов имеют исследования транспортных свойств, особенно электрич. проводимости (см. Электропроводность электролитов). Наличие ионов заметно сказывается на диффузии, вязкости, теплопроводности.
 2018-01-21
2018-01-21 973
973








