В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной оценки процесса диссоциации было введено понятие степени электролитической диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации 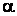 . По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных растворах они диссоциируют практически полностью. Истинная степень их диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся) находится в пределах от 30 % и выше.
. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, а также некоторые кислоты. В водных растворах они диссоциируют практически полностью. Истинная степень их диссоциации близка к 1 (100%), хотя экспериментально наблюдаемая (кажущаяся) находится в пределах от 30 % и выше.
Электролиты, степень диссоциации которых в растворе меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном, в недиссоциированном состоянии; для них α < 3%. К ним относят воду, ряд кислот, основания р -, d - и f - элементов. Между этими группами нет четкой границы, одно и тоже вещество в одном растворителе является сильным, а в другом – слабым электролитом.
Согласно теории электролитической диссоциации, кислотой является электролит, который диссоциирует с образованием ионов Н +. Присутствием ионов Н+ можно обьяснить кислый вкус, способность изменять цвет индикаторов, взаимодействовать с основаниями а также с некоторыми металлами с выделением водорода.
Сильные кислоты (HCl, HNO3, H2SO4 и др.) диссоциируют практически полностью, у слабых кислот диссоциирована лишь часть молекул. О силе кислот можно судить и по константе диссоциации: чем она больше, тем более диссоциирована кислота.
Электролит, диссоциирующий с образованием ионов ОН‾, называется основанием. Наличием ионов ОН‾ в растворе объясняется своеобразный "мыльный " вкус, способность изменять цвета индикаторов иначе, чем кислотами, способность взаимодействовать с кислотами с образованием солей.
Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых оснований диссоциирована лишь часть молекул.
Существуют электролиты, которые могут диссоциировать как кислоты, и как основания:
H+ + RO‾ = ROH = R+ + OH‾
Такие электролиты называются амфотерными электролитами. Амфотерность электролитов объясняется малым различием прочности связей R - H и О - Н. Примером амфотерного электролита может быть гидроксид цинка:
2Н+ + [Zn(OH)4]2‾ = Zn(OH)2 + 2H2O = [Zn(H2O)2]2+ + 2OH‾.
При взаимодействии гидроксида цинка с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
при взаимодействии же с гидроксидом калия – гидроксоцинкат калия:
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
К амфотерным электролитам относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2.
Соли можно определить как электролиты, которые при растворении в воде диссоциируют с образованием положительных ионов отличных от ионов водорода и отрицательных ионов, отличных от гидроксид-ионов. Соли тем лучше диссоциируют, чем меньше заряды ионов, образующих соль.
 2018-01-21
2018-01-21 1039
1039
