В органических соединениях Карбон всегда проявляет валентность 4.
Это можно объяснить тем, что в возбужденном (получившем дополнительную энергию) атоме происходит распаривание 2s-электронов и переход одного из них на 2р-орбиталь:
1. 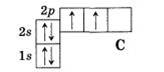
2.  Такой атом имеет четыре неспаренных электрона и может принимать участие в создании четырех ковалентных связей.
Такой атом имеет четыре неспаренных электрона и может принимать участие в создании четырех ковалентных связей.
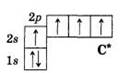
Силиций 14Si (Кремний) в основном состоянии имеет два спаренных s - электрона, два неспаренных p-электрона, одну вакантную р-орбиталь и пять вакантных d-орбиталей.
Электронно-графические формулы валентного слоя кремния в основном и валентно-возбужденном состояниях имеют следующий вид:

Силиций 14Si ( Кремний) в редких случаях проявляет валентность 2 ( SiO ), чаще валентность 4 и 6.
Распределение электронов в атоме карбона: 1s22s22p2.
Распределение электронов в атоме силиция: 1s2 2s2 2p6 3s2 3p2
Степень окисления Карбона в разных обстоятельствах бывает то +4, то –4
Степень окисления Силиция в разных обстоятельствах бывает то +2, +4, то –4 также.
Карбон (Углерод) – в любой форме – твердое тело. Ни в одном из элементов такая способность к усложнению не развита в такой мере, как в углероде.
|
|
|
Силиций (Кремний), так же как углерод, способен давать огромное количество различных соединений. Две и четыре валентные связи... Атомы силиция, так же как и углерода, способны соединяться в длинные цепочки. Но для кремния не характерно образование кратных связей Si=Si, что свойственно углероду
Оба элемента широко распространены в природе, оба - типичные восстановители. Только при непосредственном взаимодействии с активными металлами выступают в качестве окислителей
Билет 7. Оксиды. Классификация Оксидов. Химические свойства.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. (Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2)
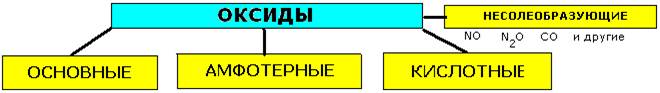
По химическим свойствам все оксиды подразделяются на солеобразующие и несолеобразующие. Несолеобраэующие – этооксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. В их состав входят неметаллы, например: оксиды азота (I и II), оксид углерода (II) — СО и некоторые другие.
Солеобразующие - это оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду, в т.ч основные и кислотные.
Классификация: → несолеобразующие↓
солеобразующие↓
 2018-01-21
2018-01-21 1266
1266








