Увеличение давления приводит к пропорциональному росту концентрации, а следовательно и скорости.
Вопрос №11 Химическая кинетика. Скорость химических реакций. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Энергия активации. Энергетические диаграммы экзо- и эндотермических процессов. Как изменится скорость реакции, имеющей температурный коэффициент g=3, при повышении температуры с 20 до 60 0С?
Химическая кинетика - раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции - это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
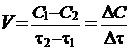 .
.
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в два - четыре раза.
 ,
,
где V 1 – скорость реакции при начальной температуре системы t 1, V 2 – скорость реакции при конечной температуре системы t 2,
γ – температурный коэффициент реакции, равный 2÷4.
Энергия, необходимая для увеличения энергии молекул реагирующих веществ до энергии активированного комплекса, называется энергией активации Еа.
Согласно уравнению Аррениуса, чем больше значение энергии активации E акт, тем в большей степени константа скорости химической реакции k зависит от температуры:
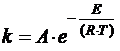 ,
,


|
|






Рис. 6.1. Энергетическая диаграмма экзотермической реакции:
E исх – средняя энергия исходных веществ; E прод – средняя энергия продуктов реакции; E мин – энергия активированного комплекса; E акт – энергия активации; Δ Hр – тепловой эффект химической реакции
Вопрос №12. Химическая кинетика. Факторы, влияющие на скорость химических реакций. Катализаторы. Зависимость скорости химических реакций от катализатора. Положительный и отрицательный катализ. Энергетическая диаграмма каталитического процесса. Какое влияние оказывает катализатор на состояние химического равновесия?
Химическая кинетика - раздел химии, изучающий скорости и механизмы химических процессов, а также их зависимость от различных факторов.
скорость реакции - это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
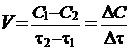 .
.
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Катализаторы - это вещества, которые повышают скорость химической реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.
 2018-01-21
2018-01-21 1015
1015
