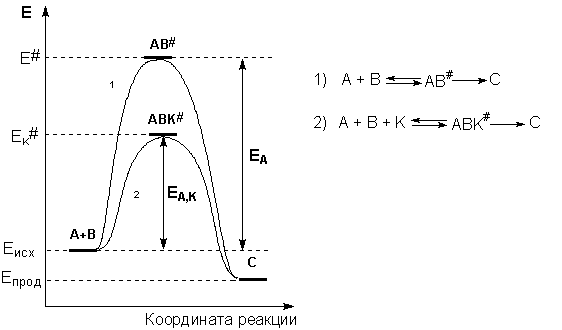
 Энергетическая диаграмма химической реакции без катализатора (1)
Энергетическая диаграмма химической реакции без катализатора (1)
и в присутствии катализатора (2).
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ" подразумевают только положительный катализ; отрицательный катализ называют ингибированием. Все катализаторы одинаково ускоряет как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
вопрос №13 Химическое равновесие. Константа химического равновесия. Влияние концентрации, температуры и давления на состояние равновесия. Принцип Ле-Шателье. Как следует изменить условия для того, чтобы равновесие реакции: COCI2 =>CO+CI2 DH> 0 сместить вправо?
Состояние системы, при котором Vпрям = Vобр называется химическим равновесием. Это равновесие является динамическим.
 ,
,
Константа химического равновесия представляет собой отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов.
 2018-01-21
2018-01-21 424
424








