Модель атома по бору.
Электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.
Вопрос №16
Квантово-механическая модель строения атома
электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями.
Вопрос №17
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
1) Главное квантовое число – это номер периода (n= 1,2,3…7)
Описывает:
L- Орбитальное квантовое число L=n – 1 (0,1,2…)
Форма орбиталей в пределах которой нахождение электронов наиболее вероятней.
Магнитное квантовое число m
Описывает ориентацию орбиталей в пространстве.
Может принимать целочисленные значения в диапазоне от -l до +l (включая 0). Например:
Для l=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию.
Для l=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации.
Для l=2: m=-2;-1;0;+1;+2 - d-орбиталь имеет пять пространственных ориентаций.
Спиновое квантовое число ms
Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½.
Квантовые числа для первых трех энергетических уровней:
На первом уровне (n=1) есть только s-орбиталь, на которой может находиться только 2 электрона со спинами +1/2 и -1/2. Это справедливо для s-орбитали любого уровня: 1s; 2s; 3s…
На втором энергетическом уровне (n=2) есть уже две орбитали s; p. На третьем (n=3) - три орбитали: s, p, d. и т.д. С каждым новым энергетическим уровнем добавляется новая орбиталь.
Для 2p-орбитали существует три пространственных ориентации (формы облака), на каждой из которых может находиться по два электрона. Т.е. на втором энергетическом может находиться не более 6 p-электронов.
Для 3d - максимум 10 d-электронов и пять форм облаков.
Главные энергетические уровни отличаются энергией. Чем выше уровень - тем выше энергия. С другой стороны, различные орбитали одного и того же уровня также обладают разной энергией:
Энергия электронов на орбитали 2p выше, чем на 2s
Энергия электронов на орбитали 3p выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3p
Что же касается электронов "внутри орбиталей", то их энергии одинаковы.
Вопрос №18
Принцип Паули: электроны располагаются так, что каждый из них имеет строго определённый набор квантовых чисел, в атоме не может быть даже двух электроновсо всеми четырьмя одинаковыми квантовыми числами.
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового-квантового числа электронов данного подслоя должен быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон.
Вопрос № 19
Правило Клечковского – элементы заполняют орбиталь таким образом, чтобы их суммарная энергия была минимум, т.е. в порядке возрастания суммы главного и орбитального квантовых чисел.
Вопрос №21
Характеристика химической связи: длина, энергия, валентный угол и направленность.
Сигма-связь – это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь – это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны π-связи и δ-связи теряют свою принадлежность к определенному атому.
Особенности δ-связи и π-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены δ-связью;
2) появление π-связи лишает атомы углерода в молекуле свободного вращения.
Вопрос №22
Ковалентная связь - химическая связь, возникающая в результате образования общих электронных пар.
Ковалентная связь бывает:
Полярная – связь, образованная атомами, электроотрицательности которых отличаются.( S,C
S,C  )
)
Неполярная – связь между атомами, электроотрицательности которых одинаковые.( ,
,  )
)
Ионная – связь, возникающая в результате электростатического притяжения катионов и анионов.( S, MgO)
S, MgO)
Вопрос №23
Металлическая – связь, которую осуществляют относительно свободные электроны между катионами Ме, образующих металлическую кристаллическую решетку.
Водородная – связь, которая имеет частично электростатический, частично ковалентный характер.
Вопрос №24
Раство́р — однородная смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Смесь — физико-химическая система, в состав которой входят два или несколько химических соединений.
По агрегатному состоянию растворы и смеси могут быть газообразными, жидкими и твердыми.
Вопрос №25
Фаза — однородная по составу, строению и свойствам часть неоднородной системы, которая может быть механически отделённой.
Дисперсная фаза — совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде.
Дисперсионная среда - непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа. Д. с. может быть твёрдой, жидкой или газовой; в совокупности с дисперсной фазой она образует Дисперсные системы.
28. Твердые растворы делятся на растворы замещения, внедрения, вычитания, твердые растворы с ограниченной и неограниченной растворимостью компонентов в твердом состоянии. Твердые растворы - это твердые фазы переменного состава. Они могут быть получены при охлаждении жидких расплавов или при растворении газов в твердых веществах. К твердым растворам относят твердые сплавы, в этом случае они представляют собой или определенное химическое соединение, или однородную смесь неопределенного состава. Твердый раствор образуется если атомы смешиваемых металлов могут замещать друг друга в кристаллической решетке, не нарушая ее структуры. Благодаря такой замене получаются совершенно однородные смешанные кристаллы,содержащие одновременно атомы обоих металлов и обуславливающие полную однородность сплава (твердого раствора).
29.Способы выражения состава растворов.
Массовая доля-отношение массы растворенного вещества к массе раствора.
Молярная доля-отношение количества растворенного вещества(или растворителя) к сумме количеств веществ состовляющих раствор.Молярная концентрация-отношение количества растворенного вещества к объему раствора. Моляльная концентрация-отношение количества растворенного вещества к массе растворителя. Эквивалентная или нормальная концентрация- отношения числа эквивалентов растворенного вещества к объему раствора.
31.Сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя (любого, чаще органического).
Гидратация в водных растворах приводит к образованию стойких и нестойких соединений воды с растворенным веществом (гидратов);В растворителях образуются нестойкие соединения молекул растворителя с растворенным веществом - сольваты. Гидратация - та же сольватация, только растворителем выступает вода. Приводит к образованию стойких и нестойких соединений воды с растворенным веществом - гидратов (те же сольваты).Гидратация имеет свою специфику т.к. при растворении в воде может происходить электролитическая диссоциация - распад в-ва в растворе на ионы с образованием электролитов. В принципе, электролитами могут быть не только водные растворы, а, например, расплавы солей, но в органических растворителях электролитической диссоциации как правило не происходит. Сольватация для всех растворов (гидратация-сольватация водным раствором)
3. Стехиометрия — раздел химии о соотношениях реагентов в химических реакциях.Позволяет теоретически вычислять необходимые массы и объёмы реагентов.Отношения количеств реагентов, равные отношениям коэффицентов в стехиометрическом уравнении реакции, называются стехиометрическими. Если вещества реагируют в соотношении 1:1, то их соответственные количества называют эквимолярными
4. Закон сохранения массы веществ: Масса реагирующих веществ равна массе продуктов реакции. Закон постоянства состава (Ж. Пруст): Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом. Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа. Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа. Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Число Авогадро – число частиц в моле любого вещества; N A = 6,02∙1023 моль–1. Молярный объем – объем моля любого газа при нормальных условиях(температура 273 К, давление 101,3 кПа); равен 22,4 л∙моль–1. Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль–1.
18. Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числаэлектронов данного подслоя должен быть максимальным. При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественныхфермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
19. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
17. Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до  : n = 1, 2, 3, 4, 5, 6, 7.
: n = 1, 2, 3, 4, 5, 6, 7.
Побочное (орбитальное) квантовое число (1) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = О, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: О, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (1 = 0) и в виде объемной восьмерки (гантелеобразная) (1 = 1).
Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (21 + 1) значений числа m. Например, если 1 = 1, то m имеет (2 x 1 + 1) 3 значения: — 1,0, +1.
Спиновое квантовое число (s) - характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 ( ) и -1/2 (
) и -1/2 ( ). (Спин электрона — свойство электрона вести себя как крошечный магнит).
). (Спин электрона — свойство электрона вести себя как крошечный магнит).
35. Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
 промeжуточной степени окисления, которая одноврeмeнно повышаeтся и понижаeтся:
промeжуточной степени окисления, которая одноврeмeнно повышаeтся и понижаeтся:
2Н2O2 = O2 + 2Н2O
3 HNO2= HNO3+ 2NO + H2O
4. Рeакции контрпропорционирования – это процeссы взаимодeйствия окислитeля и восстановитeля, содeржащиe один и тот жe элeмeнт в разных стeпeнях окислeния. В рeзультатe продуктом окислeния и продуктом восстановлeния являeтся одно и то жe вeщeство, содeржащee атомы в промeжуточной стeпeни окислeния:
Na2SO3 + 2Na2S + 6HCl = 3S + 6NaCl + 3H2O
Сущeствуют такжe тип окислительно-восстановительных реакций который нe относится ни к одному из вышe привeдeнных случаeв классификации ОВР. Это ОВР смeшанного типа. Напримeр, и к внутримолeкулярной рeакции и к рeакции контрпропорционирования относится процeсс разложeния нитрата аммония:
NH4NO3= N2O + 2H2O
СУТЬ ЭЛЕКТРОХИМИЧЕСКОЙ ЗАЩИТЫК готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
В зависимости от того, в какую сторону (положительную или отрицательную) смещается потенциал металла, электрохимическую защиту подразделяют на анодную и катодную.
42. При наличии в растворе газообразного кислорода и не возможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией, Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:
 , т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов;
, т.е. в растворах кислот, например, кислотное растворение железа, цинка и других металлов;
при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей.
40. В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) встандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различияэлектростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту. Качественное определение направления протекания окислительно-восстановительных процессов заключается в сравнении значений стандартных окислительно-восстановительных потенциалов различных редокс-пар. При этом исходят из следующих положений:
1. стандартные окислительно-восстановительные потенциалы являются количественной характеристикой как процесса восстановления, так и обратного ему процесса – окисления;
2. окисленная форма редокс-пары с большим значением 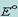 играет роль окислителя по отношению к восстановленной форме пары с меньшим значением
играет роль окислителя по отношению к восстановленной форме пары с меньшим значением  ;
;
3. чем больше  , тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность;
, тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность;
4. окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если электродвижущая сила реакции (ЭДС), вычисляемая как  , имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция;
, имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция;
5. окислительно-восстановительные процессы идут в направлении образования более слабых окислителей и восстановителей.
51. Элемент свинцово-кислотного аккумулятора состоит из электродов (положительных и отрицательных) и разделительных изоляторов (сепараторов), которые погружены в электролит. Электроды представляют собой свинцовые решётки. У положительных активным веществом является перекись свинца (PbO2), у отрицательных активным веществом является губчатый свинец. Химическая реакция (слева направо — разряд, справа налево — заряд):
Анод:  Катод:
Катод: 
58. В серебряно-цинковых аккумуляторов положительные пластины изготавливаются из чистого тем или иным способом приготовленного серебра, а отрицательные – из окиси цинка в смеси с порошком металлического цинка. Положительные пластины отделены от отрицательных несколькими слоями гидратцелюлозной пленки, применение которой обусловлено тем, что через неё, с одной стороны хорошо диффундирует электролит, а с другой стороны она препятствует миграции коллоидных частиц окислов серебра от положительного электрода к отрицательному и произрастанию дендритов цинка в противоположном направлении.
47. По возможности или невозможности повторного использования химические источники тока делятся на:
· гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
· электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
· топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент,цинк-хлорный аккумулятор).
33. Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями. Или это система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в другой фазе, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой.
Размеры коллоидных частиц варьируются в пределах от 0.001 до 0.1 мкм. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
49. Все вторичные источники питания по типу использования можно разделить на два основных класса.
Первый - это вторичные источники, или блоки бесперебойного питания, или источники вторичного электропитания резервированные (ИВЭПР). Более понятно, но редко, их называют источниками непрерывного питания. Подобные устройства предназначены для питания аппаратуры, которая не имеет своего встроенного сетевого источника питания. Как следует из названия, такие источники обеспечивают питание нагрузки всегда с указанными на них параметрами. Подобные источники питания состоят из сетевого источника питания достаточной мощности, зарядного устройства для аккумуляторной батареи (АКБ) и схемы переключения нагрузки с сетевого источника на АКБ.
Второй - это вторичные источники (блоки) резервного питания. Они предназначены для обеспечения питания нагрузки при отсутствии основного источника (сети 220 В). Работают с аппаратурой, которая имеет сетевой преобразователь и входы под резервное питание. По своей сути они представляют собой сетевые зарядные устройства для АКБ и схемы защиты.
Понятно, что источник бесперебойного питания можно использовать как источник резервного питания, но никак не наоборот. Источники резервного питания существенно дешевле, т.к. в них отсутствует мощный сетевой преобразователь.
27.По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени
60. Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне[1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию.
36. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]
41. Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой
Виды коррозии
Газовая коррозия
Атмосферная коррозия
Коррозия при неполном погружении
Коррозия по ватерлинии
Коррозия при полном погружении
Коррозия при переменном погружении
Подземная коррозия
Биокоррозия
Коррозия внешним током
Коррозия блуждающим током
Контактная коррозия
Коррозия при трении
Фреттинг-коррозия
Сплошная коррозия
Равномерная коррозия
Неравномерная коррозия
Местная коррозия
Подповерхностная коррозия
Точечная коррозия
Коррозия пятнами
Сквозная коррозия
Послойная коррозия
Нитевидная коррозия
Структурная коррозия
Межкристаллитная коррозия
Избирательная (селективная) коррозия
Графитизация чугуна
Обесцинкование
Щелевая коррозия
Ножевая коррозия
Коррозионная язва
Коррозионное растрескивание
Коррозия под напряжением
Коррозионная усталость
Предел коррозионной усталости
Коррозионная хрупкость
6.Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окисление - процесс отдачи электронов, с увеличением степени окисления
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
[править]Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов. O2, О3, Пероксиды, ClO3−, HNO3, Шестивалентный хром, MnO2 оксид марганца(IV), MnO4− перманганаты, Катионы металлов и H. Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями. 37.Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
а правила определения там по группе
39. Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox)
44. способы защиты от коррозии покрытие ортофосфорной кислотой(применяется для полного удаления ржавчины), лакокрасочное покрытие, антикоры(содержащие фосфорную к-ту),катодное покрытие(покрытие металлом или оксидом с большим потенциалом), алитирование(покрытие алюминием), лужение(покрытие оловом, кузова бентли и ролс ройс покрываются оловом для защиты от коррозии) анодное покрытие -покрытием металла мегньшим потенциалом,состоит из присоединения механическим или контактной сваркой к основному изделию.
39. Окислительно -восстановительные реакцие- реакции, при которых у веществ меняется степень окисления
KMnO4(Mn был со степенью +7)+ в-ль+НОН= MnO2(Mn стал +4)+ KOH+ продукт окисления,MnSO4(+2) + KClO3+ KOH= K2MnO4(+6)
9. pv=nRt где n=m/M. R=8.31
26.грубодисперсные системы- d>= 10(-3) cм
микрогетерогенные- суспензии и эмульсии 10(-5)<= d<=10(-3)см
коллоидные системы-10(-7)<=d<=10(-5)см
тут еще таблица как они делятся, но я не знаю как ее тебе запихнуть.
 2018-01-21
2018-01-21 10282
10282