(Смотри так же вопрос 11)
Согласно представлению о гибридизации, химические связи образуются смешанными гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180град друг относительно друга.
В молекуле CH4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в методе валентных связей необходимо привлекать теорию гибридизации атомных орбиталей.
sp  линейная 180 град Молекула ВеCl2
линейная 180 град Молекула ВеCl2
sp 2  плоская тригональная 120 градусов H2C=CH2, C6H6, BCl3
плоская тригональная 120 градусов H2C=CH2, C6H6, BCl3
sp 3  тетраэдрическая 109градусов28' [NH4]+, CH4, CCl4,
тетраэдрическая 109градусов28' [NH4]+, CH4, CCl4,
sp 2 d 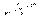 квадратная 90 град
квадратная 90 град
sp 3 d или dsp 3 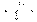 триагонально-бипирамидальная 90градусов, 120градусов PCl5
триагонально-бипирамидальная 90градусов, 120градусов PCl5
d 2 sp 3 или sp 3 d 2  октаэдрическая 90град молекула SF6
октаэдрическая 90град молекула SF6
 2018-01-21
2018-01-21 764
764








