Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реций 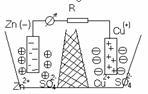
Гальванический элемент Даниэля-Якоби. Система состоит из двух электродов нах. в растворах собственных ионов. При работе элемента протекает следующие процессы: 1)реакция окисления цинка
Zn - 2e –> Zn2+
Процессы окисления в электрохимии получи название анодных процессов, а электроды, на которых идут процессы окисления назв. анодами; 2)реакция восстановления ионов меди
Cu2+ + 2e–>Cu
Процессы восстановления в электрохимии получи название катодных процессов, а электроды, на которых идут процессы восстановления, назв. катодами; 3)движение электронов во внешней цепи; 4) движение ионов в растворе: анионов к аноду, катионов к катоду. Ионы с большей концентрацией будут переходить в банку с меньшей, т.к. перегородка пористая и имеет место диффузия. Суммируя электродные реакции, получаем Zn+Cu2+=Cu+Zn2+
Вследствие этой реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. В гальваническом элементе происходит превращение химической энергии в электрическую. При помощи гальванического элемента можно совершить электрическую работу за счет энергии химической реакции.
Максимальная разность потенциалов электродов, которая может быть поучена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
Максимальная электрическая работа W=nFEэ, где Еэ-ЭДС гальв. элемента.
Максимально полезная работа W= – G.
Стандартной назв. ЭДС элемента, если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакций равны единице. Стандартная ЭДС элемента Даниэля-Якоби при 298К Еэ0=1,1В.
Концентрационные элементы (К.Э), концентрационные цепи, один из видов гальванических элементов. Различают К. э. двух типов: с переносом ионов и без переноса ионов. К. э. с переносом ионов получают погружением двух одинаковых электродов (например, серебряных) в разделённые полупроницаемой перегородкой растворы одного и того же электролита (например, нитрата серебра) различной концентрации. Электродвижущая сила в таких К. э. возникает в результате непосредственного переноса электролита из более концентрированного раствора в менее концентрированный. В К. э. второго типа выравнивание концентраций электролита происходит в результате химических процессов, происходящих на двух различных электродах.
 2018-01-21
2018-01-21 550
550








