Пример 1. Какую валентность проявляет железо, если для растворения 5,58 г его потребовалось 7,3 г хлороводородной кислоты? Какова формула образующегося хлорида железа?
Решение: Согласно закону эквивалентов:
 ;
; 
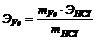
ЭНС1= МНС1=36,5; 
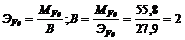
Химическая формула образующегося хлорида: FeCI2
Пример 2. Некоторая масса металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение: Зная, что эквивалентный объем водорода равен 11,2 л, составляем пропорцию
28 г металла эквивалентны 11,2 лН2
х г – 0,7 л Н2
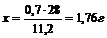
Пример 3. При сгорании металла образуется 9,43 г его оксида. Молярная масса эквивалента оксида металла равна 17 г/моль. Какая масса металла вступила в реакцию?
Решение: Учитывая, что МЭ(оксида металла)= МЭ(оксида) – МЭ(кислорода)=17-8=9 г/моль.
По закону эквивалентов найдем количество металла, вступившего в реакцию:
 ;
; 
Пример 4. Металл образует 2 хлорида, содержащих соответственно 73,86% и 84,96% металла. Вычислите молярные массы эквивалентов металла в каждом соединении.
Решение: Вычислим содержание хлора в первом хлориде, приняв массу хлорида за 100%: 100 – 73,86 = 26,14%, т.е. на 73,86 частей массы металла приходится 26,14 частей массы хлора или на 73,86 г металла приходится 26,14 г хлора.
Зная, что молярная масса эквивалента иона хлора равна 35,5 г/моль, определим молярную массу эквивалента металла. В первом хлориде по закону эквивалентов:
 ;
; 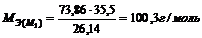
Аналогично, на 84,9 г металла приходится 15,04 г хлора во втором хлориде. Отсюда находим молярную массу эквивалента металла во втором хлориде;
 ;
; 
Пример 5. Определите, чему в данной реакции равен эквивалент соединения, формула которого подчеркнута:
H2SO4 + NaOH = NaHSO4 + H2O (1)
AI(OH)3 + 2HCI = AIOHCI2 + H2O (2)
AI(OH)2CI + 2HCI = AICI3 (3)
Na2CO3 + 2HCI = H2CO3 + 2NaCI (4)
Решение: В реакции (1) в молекуле кислоты замещается 1 ион водорода, следовательно 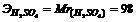
В реакциях (2) и (3) происходит замещение 2–х гидроксо–групп. Следовательно, эквивалент в этих реакциях равен Мг/2=96,4/2=48,2.
В реакции (4) эквивалент Na2CO3 определяется как эквивалент средней соли:

Закон Авогадро
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул (или атомов, если простое вещество не образует молекул – Не, Аг).
Т.к. массы молей веществ пропорциональны массам их единичных молекул, моль любого вещества содержит одно и то же число молекул.
Это число 6,0249×1023 – число Авогадро.
Моли твердых и жидких веществ также содержат 6,02×1023 молекул, а моль–атомы–такое же количество атомов.
Однако на твердые и жидкие вещества закон Авогадро не распространяется, так как моли их занимают разные объемы. Объем жидких и твердых веществ зависит не только от числа молекул (молей), но и от природы вещества (характера химической связи и составляющих его элементов).
Первое следствие из закона Авогадро.
Моли различных газов при нормальных условиях (t = 0°С или 273К, Р=101,325 кПа) занимают одинаковый объем, равный 22,4 л.
Этот объем называют молярным или мольным объемом газа.
Т.о., если вещество находится в газообразном состоянии, то 6,02×1023 молекул его (при нормальных условиях) будут занимать объем 22,4 л.
Второе следствие из закона Авогадро:
Массы равных объемов двух газов должны относиться друг к другу, как их молекулярные (или численно равные им молярные) массы:
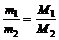
Относительная плотность газов определяется как отношение весов одинаковых объемов газов, измеренных при одних и тех же условиях:
 ;
;
где Д– относительная плотность;
r – плотность газа в литрах, г/л.
Первое следствие из закона Авогадро.
Моли различных газов при нормальных условиях (t=0°С или 273К, р = 101,325кПа) занимают одинаковый объем, равный 22,4 л.
Этот объем называют молярным или мольным объемом газа.
Т.о., если вещество находится в газообразном состоянии, то 6,02×1023 молекул его (при нормальных условиях) будут занимать объем 22,4 л.
Второе следствие из закона Авогадро.
Массы равных объемов двух газов должны относиться друг к другу, как их молекулярные (или численно равные им молекулярные) массы:
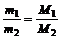
Относительная плотность газов определяется как отношение весов одинаковых объемов газов, измеренных при одних и тех же условиях:

где Д – относительная плотность;
r – плотность газа, г/л.
а значит  . Например, относительная плотность СО2 по водороду
. Например, относительная плотность СО2 по водороду
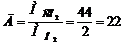 , т.е СО2 в 22 раза тяжелее водорода.
, т.е СО2 в 22 раза тяжелее водорода.
Следовательно, молекулярная масса любого газа равна его удвоенной плотности по водороду: Мх =2  .
.
Относительная плотность воздуха по водороду 14,5. Если бы воздух был индивидуальным веществом, а не смесью газов, его молекулярная масса была бы равна Мвоздуха = 2×14,5 = 29. Через эту среднюю молекулярную массу воздуха можно рассчитать плотность газов по воздуху.
Так, аммиак оказывается легче воздуха:

Т.о. молекулярную массу газообразного вещества можно определить и через плотность этого газа по воздуху:
Мх = 29×Двозд.
В этом случае, если объем газа измерен при условиях, отличных от нормальных, его можно привести к нормальным условиям, воспользовавшись следующей формулой:

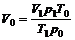 .
.
Уравнение Менделеева–Клапейрона описывает зависимость объема газа от количества вещества этого газа (молей), температуры и давления.
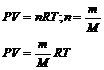
где R–универсальная газовая постоянная, равная 8,314 Дж/(моль×К);
р – давление газе;
V – его объем;
n – количество вещества в молях;
Т – абсолютная температура.
Если объем выразить в м3, а давление в паскалях, то
R = 8,314 м3×Па/(моль×К)
Физический смысл универсальной газовой постоянной (R) заключается в том, что она представляет собой работу расширения одного моля идеального газа при повышении t° на 1° при постоянном давлении.
Закон Авогадро. Решение типовых задач
Пример 1. Сколько молекул аммиака (NH3) содержится:
а) в 1 литре;
б) в 1грамме.
Решение
Число Авогадро 6,02×1023 указывает на количество молекул в 1моле (или в 22,4 л при н.у.), следовательно, в 1 л содержится 6,02×1023: 22,4 л = 2,7×1022 молекул.
Находим число молекул аммиака NH3 в 1 г из пропорции:
17 г (1 моль) – 6,02×1023 молекул
1 г – х
х = 6,02×1023: 17 = 3,5×1022 молекул.
 2018-01-21
2018-01-21 1758
1758
