Спиновое квантовое число характеризует энергетическое состояние электрона в зависимости от спина, т.е. направления вращения электрона вокруг собственной оси (по часовой или против часовой стрелки).
ms имеет значения +1/2 и -1/2.
Поэтому в атоме на каждой орбитали могут вращаться либо только один, либо два электрона. Больше быть не может.
На основе анализа атомных спектров в 1925 году ученый Паули сформулировал правило известное под названием "принцип Паули":
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Распределение электронов в атомах по энергетическим уровням и подуровням записывают при помощи электронных формул: сначала записывают цифрой номер уровня (главное квантовое число n). Затем буквой (s, p, d, f) указывают подуровень и, наконец, в виде показателя степени проставляют число электронов, находящихся в этом подуровне.
Так, например, формула аргона имеет вид:
1s2 2s2 2p6 3s23p6
Распределение электронов по уровням определяется несколькими правилами:
Энергетический принцип:
Наиболее устойчивое состояние электрона в атоме соответствует минимальному значению его энергии.
Правило Гунда:
Устойчивому состоянию атома соответствует такое распределение электронов в пределах подуровня, при котором абсолютное значение суммарного спина атома максимально:
Правило Гунда можно рассмотреть на примере атома азота:
1s2 2s2 2p3.
Электронно – графическая схема атома азота
|
|
|
|

|
|
2s2
|
|
 n =1 Суммарный спин
n =1 Суммарный спин 
|
|
|
|

|
|
|
 n =1 Суммарный спин
n =1 Суммарный спин 
т.е верным является первый вариант электронно – графической схемы.
Первое правило Клечковского
При увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n + 1). К орбиталям с большим значением этой суммы.
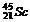 1s2 2s2 2p6 3s2 3p6 4s2 3d1
1s2 2s2 2p6 3s2 3p6 4s2 3d1
(n + l)= (1+0) (2+0) (2+1) (3+0) (3+1) (4+0) (3+2)
1 2 3 3 4 4 5
В соответствии с этим правилом электроны в первую очередь заселяют 4s – орбиталь, потому что (n + l)= (4+0) = 4, а затем одну из 3d, для которой (n + l)= (3+2) = 5, несмотря на большее значение главного квантового числа.
Второе правило Клечковского
При одинаковых значениях суммы (n + l) меньшей энергией обладает орбиталь с меньшим значением главного квантового числа n, поэтому она заселяется раньше.
В рассмотренном примере электроны вначале заселяют 3d – орбиталь, где (n + l) = (3+2) = 5, а не 4р, где (n + l) = (4+1) = 5, т.е. сумма
(n + l) в обоих случаях одинакова и равна 5, но заполняется 3d – орбиталь, для которой главное квантовое число меньше.
 2018-01-21
2018-01-21 1036
1036

