Электродный потенциал – потенциал, возникающий на поверхности металла при погружении его в раствор собственных солей. На величину данного потенциала влияют: концентрация ионов металла, его природа, температура.
Окислительно-восстановительный (редокс-) потенциал – потенциал, возникающий при переносе электронов окисленной формы вещества на восстановленную (Ох/Red). Редокс-потенциал зависит от соотношения концентраций окисленной и восстановленной форм, рН среды.
Диффузионный потенциал – потенциал, возникающий при различии в скорости диффузии катионов и анионов. Он зависит от соотношения концентраций катионов и анионов.
Мембранный потенциал - разность электрических потенциалов между наружной и внутренней поверхностями биологической мембраны, возникающий при избирательном транспорте веществ через мембрану. На величину данного потенциала влияют проницаемость мембраны и концентрация ионов на внутренней и наружной стороне мембарны.
Возникновение электродного потенциала обусловлено обратимым переходм ионов Zn2+ из металла в раствор его соли и обратно (см. Рис.1):
Zn2+ (металл) ↔ Zn2+ (раствор)
Направление самопроизвольного перехода ионов (металл→раствор, раствор→металл) определяется энергией Гиббса этих процессов.
Под действием полярных молекул воды ионы Zn2+ переходят в раствор. В этом случае энергия гидратации Ег иона металла молекулами воды больше энергии связи иона в кристаллической решетке Ем:
Ег> Ем
Поэтому катионы Zn2+ самопроизвольно переходят в раствор, Zn в растворе собственной соли заряжается отрицательно.
После наступления равновесия скорость перехода Zn2+ в раствор станет равно скорости обратного процесса:
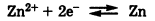
На границе раздела фаз возникает двойной электрический слой, а потенциал, возникающий в условиях равновесной электродной реакции – электродный потенциал.
Величина электродного потенциала рассчитывается по уравнению Нернста:

a (М n+) = активная концентрация ионов, 1 моль/л;
F = постоянная Фарадея, 96500 Кл/моль;
R= газовая постоянная, 8,314 Дж/моль · К
n –заряд потенциалопределяющих ионов
Электродный потенциал зависит от:
- природы Ме
- активности ионов Ме
- температуры
Рис.1

При погружении малоактивного металла (напримерCu) в раствор собственно соли (см. Рис 1):
Ег< Ем
Катионы Сu2+ самопроизвольно переходят на пластину и металл в растворе собственной соли заряжается положительно.
На границе раздела фаз возникает двойной электрический слой, а потенциал, возникающий в условиях равновесной электродной реакции – электродный потенциал.
Величина электродного потенциала рассчитывается по уравнению Нернста:

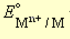 - стандартный электродный потенциал, измеренный при стандартных условиях:
- стандартный электродный потенциал, измеренный при стандартных условиях:
Т = 298 К;
a (М n+) = активная концентрация ионов, 1 моль/л;
F = постоянная Фарадея, 96500 Кл/моль;
R= газовая постоянная, 8,314 Дж/моль · К
n –заряд потенциалопределяющих ионов
ОВ- или редокс-электрод - инертный металл, например Pt, в сочетании с редокс-системой (раствор, содержащий окисленную и восстановленную формы одного и того же элемента).
Окислительно-восстановительный (редокс-) потенциал – потенциал, возникающий при переносе электронов окисленной формы вещества на восстановленную (Ох/Red). Редокс-потенциал зависит от:
- температуры
- природы окислителя и восстановителя
- концентрации окисленной и восстановленной форм
- рН среды

Роль инертного металла – посредник в переходе электронов от восстановленной формы к окисленной, катализатор электродной реакции.
Величина окислительно-восстановительного потенциала рассчитывается по уравнени. Нернста-Петерса:
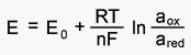
где E0 - стандартный потенциал редокс-системы;
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К);
T - абсолютная температура, К;
F - постоянная Фарадея, равная 96485 Кл/моль;
n - число электронов, принимающих участие в электродной реакции;
aox, ared – активные концентрации соответственно окисленной и восстановленной форм редокс-системы;
Потенциометрия – физико-химический метод исследования, в основе которого лежит ЭДС гальванических цепей, составляемых из индикаторного электрода и электрода-сравнения.
Потенциал индикаторного электрода или электрода-определения (например стеклянный, хингидриновый, водородный) зависит от концентрации исследуемого иона в растворе и измерении ЭДС гальванической цепи. Позволяет определить количество соответствующих ионов.
Электрод-сравнения – электрод, с постоянным значением потенциала, служит для определения потенциала индикаторного электрода. В качестве электрода-сравнения могут выступать каломельный – Hg | HgCl2, KCl, хлорсеребряный, водородный.
ОВ- или редокс-электрод - инертный металл, например Pt, в сочетании с редокс-системой (раствор, содержащий окисленную и восстановленную формы одного и того же элемента).
Окислительно-восстановительный (редокс-) потенциал – потенциал, возникающий при переносе электронов окисленной формы вещества на восстановленную (Ох/Red). Редокс-потенциал зависит от:
- температуры
- природы окислителя и восстановителя
- концентрации окисленной и восстановленной форм
- рН среды
Роль инертного металла – посредник в переходе электронов от восстановленной формы к окисленной, катализатор электродной реакции.
Ионы окисленной и восстановленной форм гидратированы различным образом, и для переноса электрона требуется преодолеть энергетический барьер. Переходы электронов от восстановленной формы на инертный металл и с поверхности металла на окисленную форму характеризуются гораздо меньшей энергией активации.
1) В случае, когда активная концентрация ионов окислителя превышает активную концентрацию ионов восстановителя

часть электронов платины должна перейти на частицы окисленной формы и пластинка приобретет положительный заряд, соответственно скорость перехода электронов из пластинки на окисленную форму больше скорости перехода электронов от восстановленной формы на платиновую пластинку:

2) Активная концентрация восстановленной формы становится больше активной концентрации окисленной формы, и часть электронов останется на поверхности платиновой пластинки, которая приобретет относительно раствора отрицательный заряд:
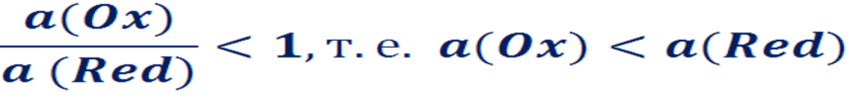
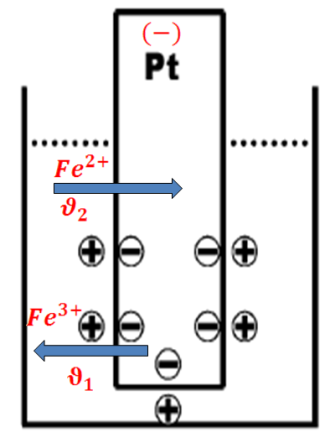
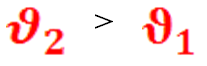
Разность потенциалов, возникающая в результате неравномерного распределения зарядов, ускоряет медленный процесс и тормозит быстрый. Через некоторое время скачок потенциалов уравновесит скорости окисления и восстановления:

Равновесия в двойном электрическом слое можно рассчитать по уравнению Нернста-Петерса:
Red ↔ Ox + ne

где E0 - стандартный потенциал редокс-системы;
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К);
T - абсолютная температура, К;
F - постоянная Фарадея, равная 96485 Кл/моль;
n - число электронов, принимающих участие в электродной реакции;
aox, ared – активные концентрации соответственно окисленной и восстановленной форм редокс-системы;
Изменение стандартной энергии гиббса связано с ЭДС окислительно-восстановительной реакции соотношением. G=-zFE
Для самопроизвольного протекания окислительно-восстановительной реакции необходимо, чтобы разность потенциалов сопряженных пар была величиной положительной, что следует из уравнения, т.е. пара, потенциал которой выше, может выполнять роль окислителя.
Реакция идет до тех пор, пока потенциалы обеих пар не станут равными. ΔEo = φ°окисл. - φ°восстан Если ЭДС реакции является отрицательной величиной, то реакция идет в обратном направлении. Чем больше ΔЕ°, тем реакция протекает более интенсивно
SnCl2 + FeCl3= SnCl4 + FeCl2,
если φ0(Sn4+/Sn2+) = +0,15 B;
φ0(Fe3+/Fe2+) = +0,77
самопроизвольный процесс 0.77-0.54=0.13
Е положительная
Оксидиметрия точнее редоксиметрия, группа методов - количественного химического анализа, основанных на окислительно-восстановительных реакциях.
Современная оксидиметрия разделяется на ряд методов: перманганатометрия, хроматометрия,броматометрия, титанометрия, цериметрия и др.
В санитарно-гигиенической практике эти методы используются для определения окисляемости воды, содержания «остаточного» хлора в хозяйственных и сочных водах, а также «активного» хлора в дезинфицирующих средствах (хлорной извести и хлорамина).
Некоторые ов-реакции используют для экстренной помощи при отравлениях окислителями или восстановителями, при ожогах белым фосфором кожу смачивают 5% раствором сульфата меди. Ов-реакции используют для диагностики (обнаружение алкоголя в выдыхаемом воздухе).
Применение потенциометрии для установления точки эквивалентности значительно расширяет область оксидиметрических определений. Число методов О. продолжает увеличиваться за счет применения новых реагентов: калия гексацианоферриата, аскорбиновой кислоты, ацетада свинца (IV), гипогалогенидов и др. О.широко применяется для анализа неорганических и органических веществ и является наиболее распространенным видом титриметрических определений.
Все биохимические окислительно-восстановительные процессы, скорость и глубина которых контролируется организмом, совершается в присутствии ферментов с общим названием оксидоредуктазы - ряд ферментов и белков, присутствующих в живых клетках, по которым передаются электроны.
Причем в живой клетке перенос ē -нов может осуществляться четырьмя способами:
1. прямой – Fe2+ ↔ Fe3+ + ē
2. в составе H2 (2H+2e)
AH2 ↔ A + 2H+ + 2ē или AH2 + B → A + BH2
Red дон.ē OX акц.ē
3. в составе гидрид-иона: H- (2ē), такой перенос имеет место в случае НАД-зависимых дегидрогеназ.
4. перенос путем прямого воздействия органического восстановителя с кислородом, приводящего к образованию продукта, в котором содержится ковалентно связанный кислород. Например:
R-CH3 + ½ O2 → R-CH2-OH
дон.ēакц.ē
Вещества, обратимо реагирующие с окислителями и предохраняющие субстраты от их действия, называются антиоксидантами.
К ним относятся:
- природные и синтетические фенолы
- витамины группы Е – токоферолы (суточная потребность- 5мг/сут)
- витамин С – аскорбиновая кислота.
Окислительно-восстановительные процессы, обеспечивающие энергетику организма, проходят ступенчато в «молекулярных энергостанциях» - митохондриях. При биологическом окислении перенос водорода от молекулы субстрата к кислороду осуществляется в несколько этапов, в ходе которых происходит изменение ОВ потенциала в виде небольших перепадов и образования свободной энергии небольшими порциями. Эффективность использования энергии при этом возрастает по сравнению с однократной разностью потенциалов между субстратом и кислородом.
Биологическое окисление можно представить в виде электрон-транспортной цепи:

Обезвреживание H2O2 происходитглутатионвойредокс-буферной системой в присутствии фермента глутатионпероксидазы, содержащей Se.
R − Se − H + H2O2 → R − Se − OH + H2O
R − Se − OH + 2R − SH → H2O + R − S − S− R + R − Se − H
R − S − S − R + НАДФН∙Н+ → НАДФ + 2R – SH
2. Супероксид ион O2- обезвреживается супероксиддисмутазой (СОД):
СОД → [Cu2+/Cu+] – в цитозоле
СОД → [Mn3+/Mn2+] – в митохондриях
[СОД ∙ Cu2+] + O2- → [СОД ∙ Cu+] + O2
[СОД ∙ Cu+] + O2- + 2H+ [СОД ∙ Cu2+] + H2O2; 2H2O2 каталаза 2H2O + O2
[СОД ∙ Mn3+] + O2- → [СОД ∙ Mn2+] + O2
2MnO2 + 3I2 + 8OH- ↔ 2MnO4- + 6I- + 4H2O
реакции 2MnO2 + 3I2 + 8OH- ↔ 2MnO4- + 6I- + 4H2O пристандартныхусловиях, еслиφ0(MnO4-/MnО2) = +0,60 B; φ0(I2/2I-) = +0,54 B
Е =φ0(I2/2I-) - φ0(MnO4-/MnО2) = 0,54 – 0,6 = - 0,06В
Реакция самопроизвольно будет протекать справа налево, т.к. φ0(MnO4-/MnО2) > φ0(I2/2I-), ион MnO4- более сильный окислитель, чем I2
Редокс-буферные системы поддерживают на заданном уровне величину редокс-потенциала. В условиях организма редокс-буферное действие выражается в поддержании определенной концентрации окислителя и восстановителя.
1.Глутатионовая – одна из важнейших редокс-буферных систем:
Глутатион- это трипептид, состоящий из остатков глутаминовой кислоты, цистеина и глицина:
NH2 − CH – CO – NH – CH – CO – NH – CH2 – COOH
| | гли
CH2 CH2
CH2 SH ← реакционныйцентр
| цис
COOH
глу
Условно: R − S–− H–
Обезвреживание H2O2 происходит в присутствии фермента глутатионпероксидазы, содержащейSe.
R − S– − H–+ H2O2 → R − Se − OH + H2O
R − Se − OH + 2R − SH → H2O + R − S − S− R + R − Se − H
R − S − S − R + НАДФН∙Н+ → НАДФ + 2R – SH
Важное значение имеет противодействие редокс-систем увеличению редокс-потенциала, поскольку организм существует и функционирует в окружающей среде, обладающей окислительными свойствами.
Токсичные окислители:
Нитрозные газы – NO, NO2, N2O3, N2O4 → в легких образуется азотистая и азотная кислоты, поражают легкие, что приводит к отеку и сложным расстройствам.
NO2 – нитрит-ион:
HbFe2+ + NO2- → HbFe3+ + NO
переносит O2 не переносит O2
аналогично действуют нитраты.
2. Супероксид ион O2- обезвреживается супероксиддисмутазой (СОД):
СОД → [Cu2+/Cu+] – в цитозоле
СОД → [Mn3+/Mn2+] – в митохондриях
[СОД ∙ Cu2+] + O2- → [СОД ∙ Cu+] + O2
[СОД ∙ Cu+] + O2- + 2H+ [СОД ∙ Cu2+] + H2O2; 2H2O2 каталаза 2H2O + O2
[СОД ∙ Mn3+] + O2- → [СОД ∙ Mn2+] + O2
Раствор бромоводородаможно окислить с помощью раствора перманганата калия, т.к.
φ0(MnO4-/Mn2+) > φ0(Br2/2Br-), отсюда следует что KMnO4 более сильный окислитель, а в сопряженной редокс-паре Br2/2Br- - бром – слабый окислитель.
Раствор бромоводорода можно окислить с помощью дихромата калия, т.к.
φ0(Cr2O72-/2Cr3+) > φ0(Br2/2Br-),отсюда следует что K2Cr2O7 более сильный окислитель, а в сопряженной редокс-паре Br2/2Br- - бром – слабый окислитель.
Укажите направление реакции при стандартных условиях:
2Сr³+ + 3Br2 + 7H2O = Cr2O7²ֿ+ 6Brֿ + 14H+
φº Br2/2Brֿ = +1,076 B
φº Cr2O7²ֿ/2Cr³+ = +1,36 B
Е = φº Br2/2Brֿ - φº Cr2O7²ֿ/2Cr³+ = 1,076 – 1,36 = -0,284 В
Реакция самопроизвольно может протекать только в обратном направлении, т.к. Е< 0,
φº Br2/2Brֿ < φº Cr2O7²ֿ/2Cr³+, дихромат-ион более сильный окислитель, чем бром
Для осуществления реакции должны соблюдаться след.условия:
Е > 0, поэтому φ0(Fe3+/Fe2+) >φ0 (Hal/Hal-)
Е = φ0(Fe3+/Fe2+) - φ0(Cl2/2Cl-) = 0,77 – 1,36 = -0,59В, Е < 0, реакция будет протекать только в обратном направлении.
Е = φ0(Fe3+/Fe2+) - φ0(I2/2I-) = 0,77 – 0,54 = 0,23 В, Е > 0, реакция самопроизвольно будет протекать в прямом направлении, поэтому для её осуществления необходимо взять иодид-ион.
Е = φ0(Fe3+/Fe2+) - φ0(Br2/2Br-) = 0,77 – 1,07 = -0,3 В, Е < 0, реакция будет протекать только в обратном направлении.
Укажите направление реакции при стандартных условиях:
3NO2ֿ + Cr2O7²ֿ + 8H+ = 3NO3ֿ+ 2Cr³++ 4H2O
Если: φº Cr2O7 ²ֿ / 2Сr³+ = +1,36 В
φº NO3ֿ/NO2ֿ= +0,94В
Е = φº Cr2O7 ²ֿ / 2Сr³+ -φº NO3ֿ/NO2ֿ = 1,36 – 0,94 = 0,42В
Е > 0, реакция протекает самопроизвольно в прямом направлении
Укажите направление реакции при стандартных условиях:
5NO2ֿ + 2MnO4ֿ + 6H+ = 5NO3ֿ + 2Mn²+ + 3H2O
Если: φº NO3ֿ /NO2ֿ = + 0,9В
φº MnO4ֿ /Mn²+ = + 1,54В
Е = φº MnO4ֿ /Mn²+ - φº NO3ֿ /NO2ֿ = 1,54 – 0,9 = 0,64В
Е > 0, реакция протекает самопроизвольно в прямом направлении
 2018-01-21
2018-01-21 6188
6188








