МЕТА: Розглянути загальнокислотні властивості сульфатної кислоти, якісну реакцію на сульфат-йон. Удосконалювати вміння ілюструвати властивості сульфатної кислоти відповідними рівняннями реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
Фізичні властивості. Сульфатна кислота H2SO4 – (безводна) – важка, безбарвна, оліїста рідина, густина 98%-вої кислоти 1,84 г/см3, сильна кислота, нелетка, запаху не має, є водовідбираючим реагентом завдяки надзвичайній гігроскопічності, їдка речовина, при розчиненні у воді виділяється велика кількість теплоти.
Хімічні властивості.
1. Дисоціація кислоти.
І ступінь:
H2SO4 ↔ Н+ + НSO  - гідроген сульфат-йон (гідросульфат-йон),
- гідроген сульфат-йон (гідросульфат-йон),
ІІ ступінь:
НSO 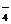 ↔ Н+ + SO
↔ Н+ + SO 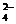 - сульфат-йон.
- сульфат-йон.
Сумарне рівняння:
H2SO4 ↔ 2Н+ + SO 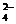 .
.
Відповідно солі сульфатної кислоти діляться на кислі і середні:
┌ солі ┐
гідрогенсульфати ← кислі середні → сульфати
(гідросульфати)
2. Взаємодія з основами.
Сульфатна кислота реагує з основами (розчинними у воді – лугами, нерозчинними у воді – гідроксидами важких металів, амфотерними гідроксидами) з утворенням кислих та середніх солей:
2КОН + H2SO4 = К2SO4 + 2Н2О (калій сульфат, середня сіль);
КОН + H2SO4 = КHSO4 + Н2О (калій гідрогенсульфат, кисла сіль).
Отже, гідрогенсульфати утворюються тоді, коли кислота перебуває у надлишку
3. Взаємодія з оксидами металів.
Сульфатна кислота реагує з оксидами металів – основними, кислотними, амфотерними:
СаО + H2SO4 = СаSO4 + Н2О (кальцій сульфат),
Al2O3 + H2SO4 = Al2(SO4)3 + Н2О (алюміній сульфат),
4. Взаємодія з солями.
Вступає в реакцію обміну з солями, утвореними слабшими або леткими чи нерозчинними у воді кислотами:
К2СО3 + H2SO4 = К2SO4 + СО2↑+ Н2О,
2КNO3 + H2SO4 = К2SO4 + 2НNO3,
ВаСl2 + H2SO4 = ВаSO4↓+ 2НСl↑,
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3.
5. Якісна реакція на сульфат-йон (на сульфатну кислоту та її солі) – взаємодія з йоном барію (тобто з розчинними солями барію чи з барій гідроксидом) – випадає молочно-білий осад, нерозчинний ні у воді, ні у кислотах:
Ва2+ + SO 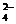 = ВаSO4 ↓.
= ВаSO4 ↓.
6. Взаємодія з металами.
а) Розбавлена сульфатна кислота реагує з активними металами, що стоять в ряді активності металів до Гідрогену з утворенням солі і виділенням водню:
Zn + H2SO4 = ZnSO4 + H2↑,
Fe + H2SO4 = Fe SO4 + H2↑.
б) Концентрована сульфатна кислота – сильний окисник. Взаємодіє з металами, що в ряду активності металів стоять після Гідрогена:
Сu0 + 2 H2S  O4 = Cu+2SO4 + S+4O4 + H2O.
O4 = Cu+2SO4 + S+4O4 + H2O.
Сu0 – 2е → Cu+2
S  + 2е → S+4
+ 2е → S+4
Продукти реакції залежать від концентрації сульфатної кислоти та активності металу. Сульфур може відновлюватися від ступеня окиснення +4 до –2 (SO4, S, H2S).
Залізо, алюміній та хром пасивуються концентрованою сульфатною кислотою на холоді, але реагують при нагріванні. Платина та золото не реагують навіть при нагріванні.
 2018-01-21
2018-01-21 1472
1472
