Іони натрію (а також калію, кальцію та магнію) присутні у всіх природних водах. Кількість натрію у природних водах коливається від декількох мг/л до сотен г/л (розсоли).
Вміст калію у природних водах значно менший, бо він добре сорбується поглинаючим комплексом грунтів та витрачається на підживлення рослин. Найбільш точним методом визначення натрію та калію є метод полум‘яної фотометрії за допомогою приладу ПАЖ-1.
Він базується на здатності атомів цих елементів збуджуватись у газовому полум‘ї, а при переході у нормальний стан випромінювати енергію у вигляді спектру ліній. При цьому кожен елемент має свій, характерний тільки для нього спектр. Вилучена з спектру аналітична лінія елементу вловлюється фотоелементом приладу, посилюється електричною схемою та виводиться на рееструючий стрілочний екран. Чим більший фотострум у приладі, тим сильніше відхилення стрілки, тим більша кількість елементу міститься у розчині. Для вилучення аналітичної лінії у приладі використовують інтерференційні та абсорбційні світлофільтри, максимум пропускання яких співпадає з аналітичною лінією елементу. Розрахунок концентрації елементу у воді зводиться до отримання графіку залежності сили фотоструму від вмісту елементу у стандартних розчинах з відомою концентрацією елементу. Показання приладу при фотометрії проби залежать від тиску компресора та коливання електричного струму, тому для більш точних вимірювань вживається метод обмежуючих розчинів, коли після фотометрування розчину, що аналізується фотометрують два стандартних з більшим та меншим вмістом елементу, ніж у пробі, що аналізується. Розрахунок ведуть за формулою:
X - X1 = 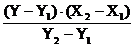 (мг/л)
(мг/л)
де Х - концентрація елементу, що визначається, мг/л;
Y - показання приладу при фотометруванні досліджуваної проби;
Х1 - концентрація елементу, що визначається у стандартному розчині
з меншим вмістом елементу;
Х2 - концентрація елементу, що визначається у стандартному розчині з
більшим вмістом елементу;
Y1 - показання приладу при фотометруванні меншого стандарту;
Y2 - показання приладу при фотометруванні більшого стандарту;
Визначення натрію іонометричним способом
Метод заснован на вимірюванні різниці потенціалів, що виникають на межі розподілу скляної мембрани індикаторного електроду та досліджуваним розчином з одного боку, та потенціалу другого електроду (електроду порівняння), що не залежить від активності (концентрації) іона натрію. Електрорушійна сила у елекричному колі, яке складається з індикаторного (натрієвого) електроду, електроду порівняння (хлоросрібного) та досліджуваного розчину, де визначається вміст іонів натрію, залежить від активності іонів натрію та температури (рівняння Нернста):
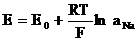
де Е - електрорушійна сила;
Е 0 - нормальний потенціал скляного електроду;
R - універсальна газова константа;
Т - абсолютна температура;
F - число Фарадея;
а Na - активність іонів натрію у досліджуваному розчині.
Необхідні хімічні реактиви та обладнання:
розчини хлориду натрію розведенням 0,1н фіксанального розчину NaCl в 10, 100 та
1000 разів;
фотометричний прилад
Na - селекційний електрод;
Na-селективний електрод.
Х і д а н а л і з у.
1. Приготувати стандартні розчини хлориду натрію розведенням 0,1н фіксанального
розчину NaCl в 10, 100 та 1000 разів.
2. Виміряти потенціал Na - селекційного електроду у цих розчинах та побудувати
графік залежності у координатах Е - Ina.
3. Виміряти потенціал Na-селективного електроду досліджуваної проби води, та
визначити вміст іону натрію за графіком.
 2018-01-21
2018-01-21 1030
1030







