Вариант №6
Часть А.
1.Электронную конфигурацию 1s22s22p63s23p64s1 в основном состоянии имеет атом
1) лития 2) натрия 3) калия 4) кальция
Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
3. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими 2) основными 3) амфотерными 4) кислотными
Химическая реакция возможна между
1) O2 иHCl 2) Fe и Na3PO4 3) Ag и Mg(NO3)2 4) Zn и FeCl2
5. В цепочке превращений N2 + X = NH3
NH3 + О2 = Y
Веществами Х и Y соответственно являются
1) вода и оксид азота (II) 2) водород и оксид азота (IV)
3) водород и азот 4) вода и оксид азота (IV)
Пентен-1 и гексен-1 являются
1) одним и тем же веществом 2) структурными изомерами
3) геометрическими изомерами 4) гомологами
Реакции присоединения характерны для
1) алканов 2) предельных одноосновных карбоновых кислот
3) фенолов 4) алкинов
Атом кислорода в молекуле фенола образует
1) одну σ-связь 2) две σ-связи 3) одну σ- и одну π-связи 4) две π-связи
При кислотном гидролизе этилацетата образуются
1) этанол и муравьиная кислота 2) этанол и уксусная кислота
3) метанол и муравьиная кислота 4) метанол и уксусная кислота
10. В схеме н-гептан → А→ метилциклогексан веществом А является
1) толуол 2) циклогексан 3) 1,2-диметилциклопентан 4) циклогептан
Часть В.
Установите соответствие между исходными веществами и образующимся в результате реакции газом
| № | Исходные вещества | Выделяющийся газ | |
| А) | Al2S3 + H2O → | 1) | H2S |
| Б) | NaHCO3(р-р) + CuSO4 (р-р) → | 2) | SO2 |
| В) | Ca3P2 + H2O → | 3) | H2 |
| Г) | Be2C + H2O → | 4) | PH3 |
| 5) | CH4 | ||
| 6) | CO2 | ||
| 7) | C2H2 |
2. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
| A) SO2 + Н2O | 1) CaSO3 + Н2 |
| Б) SO3+ Н2O | 2) CaSO3 + Н2O |
| В) SO2 + Са(ОН)2 | 3) CaSO4 +Н2 |
| Г) SO3 + Са(ОН)2 | 4) CaSO4 + Н2O |
| 5) H2SO3 | |
| 6) H2SO4 |
В отличие от одноатомных предельных спиртов фенолы
1) взаимодействуют с бромной водой
2) не реагируют со щелочами
3) вступают в реакции с хлоридом железа (III)
4) подвергаются межмолекулярной дегидратации
5) образуют сложные эфиры с карбоновыми кислотами
6) вступают в реакции поликонденсации
Часть С.
1. Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
NО + KC1О +... --> KNO3 + ….+ Н2О.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CaC2 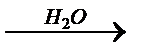 X1
X1 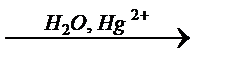 X2→ H3C–COOH
X2→ H3C–COOH 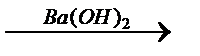 X3→ (CH3)2C=O
X3→ (CH3)2C=O
 2018-01-21
2018-01-21 1135
1135






