Решение
Используя следствие из закона Гесса, запишем
Подставим данные из условия и получим
-380,6=(2-493,2-286)-(+2-425)
Проводим арифметические вычисления:
-380,6=-422,4-.
Отсюда
кДж/моль
4. Железо, кобальт, никель. Основные степени окисления, положение в электрохимичес- ком ряду напряжения металлов, отношение к кислотам.
Карбонилы. Получение и окислительные свойства Fe(III) и Со(III).
Железо, кобальт и никель в виде простых веществ представляют собой ферромагнитные серебристо-серые, тяжелые, тугоплавкие металлы. Эти металлы обладают большой механической прочностью, могут прокатываться, протягиваться и штамповаться.
Металлы семейства железа теряют пластичность при загрязнении углеродом, кремнием, фосфором, серой и бором. Свойства металлов зависят от степени чистоты и степени измельчения металлов.
Для элементов семейства железа, находящихся в VIIIБ-подгруппе, характерны степени окисления: 0, +2, +3, +6.
Электронные конфигурации:
| Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | |
| Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | |
| Ni | никель | 1s 22s 22p 63s 23p64s 23d8 |
|
|
|
В нормальном состоянии элементы семейства железа на внешнем слое имеют два электрона, поэтому для этих элементов характерны металлические свойства.
Валентные электроны этих элементов относятся к двум энергетическим уровням.
В химических реакциях они легко отдают два электрона с 4s-подуровня, с образованием соединений в которых они проявляют валентность равную двум и степень окисления +2.
При образовании соединений с более высокой валентностью и степенью окисления (+3), металлы отдают электроны с 4s-подуровня и с не полностью заполненного d-подуровня. У железа наиболее устойчивыми являются соединения со степенью окисления +3, у кобальта и никеля – +2.
Элементы семейства железа в своих соединениях проявляют только положительные степени окисления. Таким образом, как и все d-элементы они образуют связи за счёт орбиталей внешнего и предвнешнего слоев.
Для элементов семейства железа существует большое число различных нестехиометрических соединений (Fe3P, Fe4N, CoP3, Ni6S5 и других).
В природе в рудах содержится больше, чем платиновых металлов. Предполагается, что ядро Земли состоит из сплава железа и никеля, Эти элементы входят в состав метеоритов.
Наиболее ценными являются оксидные руды железа. Кобальт и никель чаще всего встречаются в виде сульфидных минералов.
Fe3O4 - магнетит
Fe2O3 - гематит
FeO(OH) - лимонит
FeCO3 - сидерит
FeS2 - пирит
CoAsS - кобальтин
(Fe,Ni)S - петландит
NiS(As) – никелин
Получение простого вещества:
Металлические железо, кобальт и никель получают восстановлением оксидов с помощью различных восстановителей (водорода,оксида углерода(II), углерода, алюминия и т. д.), а также электролизом их солей.
|
|
|
· 2 Fe2O3 + 6 CO = 4 Fe + 6 CO2
Fe2O3 + C = Fe + CO
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO = CO2 + 2Fe3O4,
Fe3O4 + CO = CO2 + 3FeO,
FeO + CO = CO2 + Fe
или FeO + C = CO + Fe.
· Алюминотермический способ восстановления никеля из оксидной руды:
3NiO + 2Al = 3Ni +Al2O3
· Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
Железо при обычном давлении существует в виде 4 кристаллических модификаций:
α-Fe – при низких температурах, объемно-центрированная кубическая решетка, обладает ферромагнитными свойствами (при температуре ниже 769оС).
β-Fe – в интервале 759-917 оС, парамагнитное вещество
γ-Fe – при 917-1394 оС, гранецентрированная кубическая решетка
δ-Fe – выше 1394 оС, объемно-центрированная кубическая решетка
При резком охлаждении высоскотемпературные модификации железа не успевают полностью перейти в α-модификацию. На этом основаны методы закалки стали.
Все три металла проявляют умеренную химическую активность. Горят в атмосфере кислорода, образуя оксиды Fe2O3, CoO, NiO.
Железо находится в середине электрохимического ряда напряжений металлов, левее Н2, поэтому является металлом средней активности. Металлические свойства и химическая активность в ряду Fe – Co – Ni понижается
Железо не устойчиво на фоне влажного воздуха (но! Железо высокой чистоты не ржавеет)
Feо+ Н2О + О2 -> Fe2+ -> Fe3+ -> Fe2O3*(H2O)x
Кобальт и никель с водой не взаимодействуют.
Оксид железа (3) – рыхлое бурое вещество, не лежит на слое материнского металла, отваливается, оголяя чистый металл.
Fe (+2) основные свойства
Fe (+3) амфотерные свойства
Fe (+6) кислотные свойства
Взаимодействие с кислотами
в холодных серной конц и азотной конц пассивируют все 3 металла
Железо реагирует с разбавленными растворами соляной и серной кислот, образуя соли железа (II):
Fe + 2HCl = FeCl2 + H2,
Fe + H2SO4 = FeSO4 + H2;
с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
При обычных условиях концентрированные (до 70 мас. %) серная и азотная кислоты пассивируют железо. При нагревании возможно взаимодействие с образованием солей железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O,
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O.
По отношению к кислотам кобальт и никель устойчивее железа, медленно реагируют с неокисляющими кислотами с образованием солей кобальта (II) и никеля (II) и водорода. С разбавленной азотной кислотой образуют нитраты кобальта (II) и никеля (II) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты:
3Э + 8HNO3 = 3Э(NO3)2 + 2NO + 4H2O.
При обычных условиях концентрированные серная и азотная кислоты пассивируют кобальт и никель, хотя в меньшей степени, чем железо. При нагревании возможно взаимодействие с образованием солей железа двухвалентных металлов:
Co + 2H2SO4 = CoSO4 + SO2 + 2H2O,
Ni + 4HNO3 = Ni(NO3)2 + 2NO2 + 2H2O
Образование карбонилов
Для металлов триады железа характерно образование карбонилов, в которых железо, кобальт и никель имеют степень окисления, равную 0. Реакцию используют для получения из технических металлов эти металлы высокой чистоты (образованные карбонилы разлагают при более высокой температуре).
Карбонилы железа и никеля получаются при обычном давлении и температуре 20–60 °С:
Fe + 5CO = [Fe(CO)5] – желтоватая жидкость
Ni + 4CO = [Ni(CO)4].
Карбонилы кобальта образуются при давлении 2·107 – 3·107 Па и температуре 150–200 °С:
|
|
|
2Co + 8CO = [Co2(CO)8].
Карбонилы тяжелых металлов ядовиты.
2CoCO3+2H2+8CO=[CO2(CO8)]+2CO2+2H2O
[CO2(CO8)]+2NA=2NA[Co(CO)4]
2[NI(CO)4]+5O2=2NIO+9CO2
[FE(CO)5]+2NO=[FE(CO)2(NO)2]+3CO
| FeSO4 + 6KCN → K4[Fe(CN)6] + K2SO4 |
Получение и окислительные свойства Fe(III) и Со(III)
При переходе по ряду Fe-Co-Ni трехвалентное состояние элементов становится всё менее характерным, а окислительные свойства ионов Fe3+, Co3+ и Ni3+ усиливаются, что видно из уравнений следующих реакций:
Fe(OH)3 + 3HCl →FeCl3 + 3H2O
2Ni(OH)3 + 6HCl→2NiCl2 + Cl2 + 6H2O
4Co(OH)3 + 4H2SO4 →4CoSO4 + O2 + 10 H2O
Окислительные свойства соединений железа(III) в отличие от соединений кобальта(III) и никеля(III) выражены слабее и проявляются только в кислой среде под действием сильных восстановителей, чем выше концентрация ионов водорода в растворе, тем сильнее выражены окислительные свойства соединений железа(III):
2FеС13 + 2КI → 2FеС12 + I2 + КС1
Fе2(SО4)3 + Nа2S → 2 FeSО4 + S + Nа2SО4
Образование комплексных ионов стабилизирует трехвалентное состояние кобальта
и никеля. Напротив, гексациано-(III)-феррат калия является сильным окислителем,особенно в щелочной среде:
W + 6K3 [Fe(CN)6] + 8 KOH → 6K4[Fe(CN)6] + K2WO4 + 4H2O
Гидроксиды кобальта III и никеля III могут быть получены окислением соответствующих гидроксидов Со (II) и Ni (II). Гидроксид железа III осаждается щелочами из растворов солей железа (III)
2 FеСО3 + ½ О2 → Fe2О3 + 2 СО2
Fe2О3 + 6 НС1 = 2 FeС13 + 3 Н2О
FеС13 + 3 КОН = Fe(OH)3↓ + 3 КС1
2 FеС13 + 3 Nа2СО3 + 3 Н2О = 2 Fe(OH)3↓ + 6 NаС1 + 3 СО2↑
2CoCl2 + Cl2 + 6NaOH = 2Co(OH)3 + 6NaCl
Гидроксид кобальта (III) – темно-коричневое вещество, обычно нестехиометрического состава. медленно реагирует с азотной и серной кислотами, проявляя окислительные свойства, например: 4Co(OH)3 + 4H2SO4 = 4CoSO4 + O2 + 10H2O.
4Co(NO3)3=2Co2O3+12NO2+3O2
4FESO4=2FE2O3+4SO2+O2
2NIO(OH)+6HCL=2NICL2+CL2+4H2O
2FECL3+H2S=2FECL2+S+2HCL
FE2O3+KCLO3+4KOH=2K2FEO4+KCL+2H2O

4CoF3+2H2O=4CoF2+O2+4HF
5. Азотоводородная кислота: получение, кислотные и окислительные свойства. Строение азид-иона. Азиды металлов.
Азидоводородная кислота -легколетучая взрывчатая жидкость (по силе приближается к уксусной). Ее соли – азиды тяжелых металлов – взрываются при ударе и используются как детонаторы. Получение:
|
|
|
1. N2H4 + HNO2 = HN3 + 2H2O
2. 2NaNH2 + N2O = NaN3 + NaOH + NH3
3NaN3 + H3PO4 = 3 HN3 + Na3PO4
В разбавленных растворахазотистоводородная кислота медленно диспропорционирует: HN3 + H2O = N2 + NH2OH
В безводном состоянии она может взорваться не только при нагревании, но и от сотрясения: 2HN3 = H2 + 3N2
Азотистоводородная кислота функционирует как окислитель:
2HI +HN3 = I2+ NH3 + N2
Cu +3HN3 = Cu(N3)2 + N2 + H3N
Смесь концентрированной соляной и азотистоводородной кислот способна растворять даже благородные металлы. Окислительная активность этой смеси обусловлена возникновением атомарного хлора (НN3 - окислитель):
HN3+ 3HC1 = 2Cl + N2 + NH4CI
Соли азотистоводородной кислоты — азиды - по растворимости в воде похожи на галогениды. Так, азиды щелочных металлов хорошо растворяются в воде, AgN3, Pb(N3)2 и Hg(N3)2 - плохо. Азиды щелочных и щелочноземельных металлов при медленном нагревании устойчивы вплоть до плавления. Азиды тяжелых металлов легко взрываются при ударе: Pb(N3)2 = Pb + 3N2
Азидный ион по многим свойствам напоминает анионы галогенов, за что его иногда называют псевдогалогенидным ионом. В соответствии
с sp-гибридизацией валентных орбиталей N+ имеет линейную форму с
одинаковой длиной связей. В следствие наличия N5+ проявляет
окислительные свойства, а благодаря наличию N3+ - восстановительные
свойства. 
6. Буферные растворы; механизм буферного действия; буферная ёмкость – на примере аммиачного буферного раствора.
Механизм действия буферной системы рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4Сl.
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4Сl=>NН4+ + Сl- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Поэтому С (NН4ОН) = C(основания); а С (NН4+) = С(соли).
Если в буферном растворе С (NН4ОН) = С (NН4Сl), то рН = 14 - рКосн. = 14 + lg 1,8.10-5 = 9,25.
Способность буферных смесей поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами аммиака или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора.
При добавлении щелочи ионы ОН- будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора.
Буферное действие прекращается, как только одна из составных частей буферного раствора (сопряженное основание или сопряженная кислота) полностью израсходуется.
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.
Свойство растворов сохранять значение рН в определенных пределах при добавлении небольших количеств кислоты или щелочи называется буферным действием. Растворы, обладающие буферным действием, называются буферными смесями.
NH4OH+H+ = NH4+ + H2O
NH4+ + OH- = NH4OH
[OH-]/10 = Kb*(Cnh4oh -B)/Cnh4+ + B)
7. Железо. Отношение к азотной, серной (разб. и конц.) кислотам. Окислительно-восстановительные свойства Fe(II) и Fe(III). Комплексные соединения железа. Получение и окислительные свойства солей Fe(VI).
Fe2O3 + C (t)= Fe0 + CO; Fe0 – реакционоспособен, не очень устойчив на фоне «влажного воздуха»
4Fe + 2Н2О + 3O2 = 2(Fe2O3 ·Н2О) процесс коррозии
С азотной к-той: Fe + 4HNO3(разб.) = Fe(NO3)3 + NO↑ + 2H2O
С серной к-той: Fe + H2SO4 разб = FeSO4 + H2
2Fe + 6H2SO4 конц = Fe2(SO4)3 + 3SO2 + 6H2O
Концентрированные холодные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании.
При нагревании кислоты-окислители взаимодействуют с железом с образованием железа (III) и продуктов восстановления азотной кислоты (NO, NO2, N2O, N2, NH3 и т.д.). В химической реакции, обычно, записывается какой-то один продукт, который образуется в наибольшем количестве. Водные растворы железа (III) окрашены в желтый цвет, соответствующий окраске аквакомплекса [Fe(H2O)6]3+.
2Fe + H2SO4(конц.) = Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) = Fe(NO3)3 + 3NO2 + 3H2O
Оксид железа (II) не растворяется в воде, поэтому соответствующий гидроксид получают косвенным путём, например, при взаимодействии соли Мора с раствором щёлочи:
2NaOH + (NH4)2Fe(SO4)2·6H2O = Fe(OH)2↓+ Na2SO4 + (NH4)2SO4 + 6H2O
Fe(OH)2 — соединение белого цвета. На воздухе быстро окисляется, превращаясь сначала в гидратированный оксид состава Fe3O4 x H2O зелёного цвета, а затем в частично обезвоженный бурый гидроксид Fe(OH)3:
4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
Гидроксид железа (II) легко растворяется в кислотах с образованием солей Fe(II) и не растворяется в растворах щелочей, т. е. проявляет исключительно основные свойства. Железо (II) образует множество как хорошо растворимых, так и плохо растворимых солей.
Соединения железа (II) обладают восстановительными свойствами:
2FeCl2 + Cl2 = 2FeCl3
4FeSO4=2Fe2O3+4SO2+O2
Качественной реакцией на железо (II) является реакция с K3[Fe(CN)6] (красной кровяной солью). В данной реакции образуется синий малорастворимый осадок – “турнбулева синь”:
(NH4)2Fe(SO4)2·6H2O + K3[Fe(CN)6] = KFe[Fe(CN) 6]↓ + K2SO4 + (NH4) 2SO4 + 6H2O
Оксид железа (III)
Получение в лаборатории: 4Fe(NO3) 3 = 2Fe2O3 + 12NO2↑ + 3O2↑
У оксида Fe(III) преобладают основные свойства. Он растворяется в кислотах, образуя соли Fe(III): Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Гидроксид Fe(III) обладает амфотерными свойствами с преобладанием основных. Поэтому он легко растворяется в кислотах:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O и не растворяется в щелочах. Подтверждением наличия у Fe(OH)3 кислотных свойств является существование гидроксокомплексов, простейшими из которых являются [Fe(OH)4]- и [Fe(OH)6]3-. Их можно получить, добавляя по каплям раствор соли Fe(III) в избыток концентрированной щёлочи: Fe3+ + 4OH- → [Fe(OH)4]-
[Fe(H2O)6]3+ + HOH ↔ [Fe(H2O)5OH]2+ + H3O+
В присутствии сильных восстановителей железо (III) проявляетокислительные свойства, например:
FeCl3 + 2KI = FeCl2 + KCl + I2, 2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
Качественные реакции: FeCl3 + 3 КCNS = Fe(CNS)3 + 3 KCl
FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl
3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 Kcl
Fe+2NaOH+2H2O=NA2[FE(OH)4]+H2
Соединения железа (VI). Степень окисления +6 железо проявляет в ферратах, например, K2FeO4.
Одним из способов получения ферратов (VI) является окисление соединений Fe(II) или Fe(III) хлором или бромом. Для стабилизации высокой степени окисления железа нужна щелочная среда:
2FeCl3 + 16KOH + 3Cl2 = 12KCl + 2K2FeO4 + 8H2
Ферраты термически нестабильные соединения и разлагаются уже при 200 ° С:

Феррат калия проявляет более сильную окислительную способность, чем перманганат:

4K2FeO4+10H2O=4Fe(OH)3+3O2+8KOH
8. Диоксид азота: его получение, взаимодействие с водой и раствором щёлочи. Азотистая кислота, нитриты, их окислительно-восстановительные свойства. Нитрит-ион как лиганд.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
2Pb(NO3)2= 2PbO +4NO2 +O2
2NO2+H2O=HNO2+HNO3 (НЕУСТОЧНИВО)
РЕАЛЬНЫЕ ПРОДУКТЫ:
3NO2+H2O=NO+HNO3
2KOH(разб) + 2NO2= KNO2 + KNO3 + H2O
2KMnO4+3H2SO4+5KNO2=2MnSO4+K2SO4+5KNO3+3H2O
2KNO2+2FeSO4+2H2SO4=2NO+Fe2(SO4)3+2H2O+K2SO4
KNO2+3ZN+5KOH+5H2O=3K2[ZN(OH)4]+NH3
3HNO2=HNO3+H2O+2NO
| Нитрит-ион NO2- имеет угловую форму. SP2 ГИБР Проявляет восстановительные свойства 5КNO2+ 2KMnO4 + 3H2SO4 ↔ 2MnSO4 + 5KNO3 + K2SO4 + 3H2O Проявляет окислительные свойства 2КNO2+ 2KI + 2H2SO4 ↔ 2NO + I2 + 2K2SO4 + 2H2O Нитрит – ион как лиганд может координироваться через атом азота, образуя нитро-комплексы, или через атом кислорода, образуя нитрито-комплексы. Такая изомерия известна для комплексов многих переходных металлов (Co3+, Rh3+, Ir3+, Pt4+). В реакциях образования комплексов Co3+ с нитрит-ионами вначале получаются нитрито-комплексы, имеющие розовую окраску которые со временем переходят в устойчивые желто-коричневые нитро-комплексы. Следует отметить, что являясь лигандом сильного поля, нитрит-ион стабилизирует в комплексах высокие степени окисления 3d-металлов. Например, Co3+ в Nа3[Со(NО2)6]. В НАЧАЛЕ ОБРАЗУЮТСЯ нитрито-комплексы: [Co(NH3)6]3+ + NO2- =[Co(NH3)5(ONO)]2+ +NH3 которые со временем переходят в усточивые нитро-комплексы [Co(NH3)5 |
9. Гетерогенные равновесия в растворах малорастворимых солей, произведение растворимости. Факторы, влияющие на растворимость малорастворимых солей.
а)Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой поверхностью раздела. Свойства фаз отличаются друг от друга и примерами таких гетерогенных систем могут являться две несмешивающиеся жидкости, осадок и насыщенный раствор над ним, газ и твердое вещество и др.
Равновесие, устанавливающееся в гетерогенной системе на границе раздела фаз, называется гетерогенным равновесием. Гетерогенная система «осадок – раствор» представляет собой осадок малорастворимого соединения, например, сульфата бария BaSO4, находящийся в равновесии с его насыщенным раствором: BaSO4 (т) ↔ Ba2+ + SO4 2- (р). Напомним, что насыщенным называется раствор, содержащий максимальное количество вещества, которое может раствориться в данном объѐме раствора при данной температуре и давлении. Насыщенный раствор устойчив во времени. Пересыщенный раствор – это раствор, в котором содержится бóльшее количество вещества, чем в насыщенном. Такой раствор неустойчив и избыток вещества выделяется из него в твердую фазу, то есть образуется осадок. Процесс протекает до образования над осадком насыщенного раствора.
Ненасыщенный раствор характеризуется меньшим количеством растворенного вещества, чем насыщенный, и в нем может быть растворено дополнительное количество вещества до получения насыщенного раствора. Концентрация вещества в насыщенном растворе называется растворимостью. Растворимость является количественной характеристикой способности вещества растворяться.Вещества, молярная растворимость которых не превышает 10-2 моль/л, обычно считают малорастворимыми. Примерами малорастворимых солей могут служить сульфат бария BaSO4, карбонат кальция СаСО3, хлорид серебра AgCl, сульфид цинка ZnS, растворимость которых в воде очень мала.
б) Расчеты растворимости и констант произведений растворимости в системе осадок – раствор.
Из уравнения для константы произведения растворимости можно вывести формулу для растворимости веществ. Под растворимостью понимают способность вещества образовывать гомогенную систему с растворителем. Растворимость в аналитической химии применяют в размерности моль/л.
Растворимость осадков – важная величина, которая разрешает определять концентрацию вещества в насыщенном растворе, рассчитать возможность образования осадка при данной ее концентрации.
Если осадок состоит из ионов одинакового заряда (тип АВ), то в растворе над ним концентрацию молекул вещества можно принять равной концентрации ионов, которые образуются из них, так как одна молекула вещества 
AB «A + B
дает один катион и один анион:
[AB] = [A] = [B].
Подставим в выражение концентрационной константы произведения растворимости вместо концентраций [A] и [B] значение концентраций молекул вещества [AB], которое равно растворимости осадка S, получим:
ПРС = [A] ×[B] = [AB][AB] = S × S = S2,
откуда растворимость

Для осадка электролита, который состоит из ионов разных зарядов:
АmВn <=> mA + nВ
ПРС = [A]m [B]n,
[A] = m[AmBn] = m×S;
[B] = n[AmBn] = n×S;
ПРС = (mS)m(nS)n = mmnn × Sm+n;
Откуда растворимость S:

Например, для осадка Ag2CrО4:

Чем меньше растворимость, тем труднее растворяется электролит и наоборот.
Произведение растворимости многих веществ определено. Если значение ПР неизвестно, то его можно рассчитать по растворимости вещества, найденной по таблице растворимости или определенной экспериментально по концентрации ионов, которые находятся в насыщенном растворе этого вещества (над осадком). Значение ПРСрассчитывают за формулой

При расчетах растворимости следует помнить, что если:
1) ионную силу можно принять равной нулю и протеканием конкурирующих реакций пренебречь, то растворимость осадка рассчитывают по величине ПРТ;
2) влиянием ионной силы пренебречь нельзя (достаточно растворимое соединение или малорастворимое соединение в присутствии посторонних электролитов), но конкурирующие реакции отсутствуют, то растворимость рассчитывают по величине ПРС(Р);
3) конкурирующими реакциями пренебречь нельзя, тогда растворимость рассчитывают по величине ПРУ.
Обычно можно использовать и еще одно приближение: изменение растворимости осадка за счет конкурирующих реакций значительно больше, чем за счет электростатических взаимодействий ионов, поэтому при расчете растворимости осадка в условиях протекания конкурирующих реакций без особых погрешностей коэффициенты активности часто можно принять равными единице:

в) Влияние химических факторов на растворимость малорастворимых электролитов.
Пример 1. Какая растворимость оксалата кальция, если 
Так как, ПРТ достаточно маленькое, то можно пренебречь создаваемой ионной силой. Конкурирующей реакции
С2О42– + Н2О <=> НС2О4– + ОН–;
НС2О4– + Н2О <=> H2C2O4 + OH–.
Так как С2О42– и НС2О4– очень слабые основания, то этими конкурирующими реакциями можно пренебречь.
S S S
CaC2O4 <=> Ca2+ + C2O42–



Пример 2. Рассчитайте растворимость оксалата кальция в 0,01 М растворе нитрата калия.
В таком случае величиной ионной силы пренебречь нельзя, так как концентрация постороннего электролита достаточно высокая. Конкурирующими реакциями можно пренебречь.
Рассчитать ионную силу раствора

 =1/2сумма(сi*z^2 I)
=1/2сумма(сi*z^2 I)
-lgfa=(0,5z^2 -sqrt(мю)/(1+sqrt(мю)
За таблицами 
Рассчитываем концентрационное (реальное) ПР при m = 0,01:


Пример 3. Рассчитайте растворимость оксалата кальция в 1×10-3 М растворе хлоридной кислоты.
Так как среда кислая, необходимо учесть кислотно-основные реакции с участием оксалата-иона:
С2O42– + H+ <=> HC2O4–;
HC2O4– + H+ <=> H2C2O4.
Соответственно CaС2O4<=> Ca2+ + C2O42–.

Рассчитываем a-коэффициент для оксалата-иона при рН = 3,0;

Рассчитываем условную константу произведения растворимости

Пример 4. Рассчитайте растворимость сульфата бария в 0,1 М растворе сульфата натрия.
Для расчета растворимости сульфата бария в данном случае необходимо учесть, что она: а) она уменьшается под действием одноименного иона; б) одновременно увеличивается за счет увеличения ионной силы. Поэтому


Рассчитаем ионную силу, которую создают ионы натрия и сульфата

 Тогда
Тогда  а
а 
Пример 5. Рассчитать растворимость фосфата магния и аммония в 0,1 М растворе хлорида аммония.
Растворимость фосфата магния и аммония в присутствии хлорида аммония определяется:
а) действием одноименного иона;
б) протеканием конкурирующей реакции
PO43– + NH4+ <=> HPO42– + NH3;
в) увеличением ионной силы.
Первый фактор уменьшает растворимость, два последних – увеличивают. Итак, MgNH4PO4 <=> Mg2+ + NH4+ + PO43–.

Для расчета условного произведения растворимости необходимо рассчитать a-коэффициент PO43--иона. рН раствора задает наличие слабой кислоты NH4+.

[H+] = 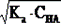 ; [H+] =
; [H+] =  .
.
При этом значении рН рассчитываем a  :
:
 .
.
Для ионной силы m = 0,1 находим 
Рассчитываем ПРу = 
Тогда растворимость: S =  M.
M.
В отсутствии посторонних электролитов, в чистой воде, без конкурирующих реакций: 
Пример 6. Рассчитайте растворимость йодида аргентума в 1 М растворе аммиака.
Для расчета растворимости необходимо использовать ПРу, так как протекают конкурирующие реакции: 



Рассчитываем  (для сравнения ПРТ = 9,98×10-17).
(для сравнения ПРТ = 9,98×10-17).
Рассчитываем растворимость AgІ:

1. Влияние одноименного иона
При увеличении концентрации иона Cl–растворимость AgCl сначала уменьшается, а затем резко возрастает вследствие образования растворимого комплекса [AgCl2]–. При увеличении концентрации иона Ag+растворимых комплексов не образуется, и растворимость осадка закономерно уменьшается, но при очень высоких концентрациях Ag+наблюдается некоторое увеличение растворимости, связанное с увеличением ионной силы раствора и, соответственно, увеличением реального произведения растворимости ПРс.Эффект увеличения растворимости, обусловленный увеличением ионной силы, называется солевым эффектом (или эффектом высаливания), и наблюдается всегда при увеличении концентрации электролита в растворе малорастворимого соединения.
2. Влияние конкурирующих реакций
Ионы осадка могут вступать в реакцию с компонентами раствора, собственными ионами, посторонними веществами. Наличие конкурирующих реакций всегда приводит к повышению растворимости вплоть до полного растворения осадка.
Например, в растворе оксалата кальция наряду с реакцией
CaC2O4 = Ca2++ C2O42–в кислой среде могут протекать конкурирующие реакции:
С2О42–+ Н+= НС2О4–НС2О4–+ Н+= Н2С2О4
Растворимость складывается из равновесных концентраций всех форм оксалат-иона:
s(С2О42–) = [C2O42–] +[НС2О4–] + [Н2С2О4]
Расчёты показывают, что растворимость оксалата кальция в чистой воде равна 4,8∙10–5моль/л, а при рН =3 — 2,0 ∙10–4моль/л.
3. Влияние ионной силы
Увеличение ионной силы раствора приводит к уменьшению коэффициентов активности ионов осадка, увеличению реального произведения растворимости и, как следствие, к увеличению растворимости(солевой эффект).
4. Влияние температуры
Характер влияния температуры на растворимость определяется знаком ∆Нрастворения. Чаще всего процессы растворения твёрдых веществ―эндотермические. Следовательно, повышение температуры будет способствовать растворению.
5. Влияние размеров частиц, образующих осадок
Энергия Гиббса ионов внутри кристаллов меньше, чем на поверхности. Чем меньше размеры частиц осадка, тем больше его поверхность и суммарная энергия Гиббса и, следовательно, растворимость. Таким образом, чем крупнее частицы, тем система стабильнее.
Пример1. Рассчитайте растворимость фосфата бария, если
ПРо(Ba3(PO4)2) = 6,3·10–39.
Решение:
Ba3(PO4)2 = 3Ba2++ 2PO43–
Если s– растворимость фосфата бария, то: [Ba2+]= 3s, [PO43–] = 2s.
ПРо= (3s)3(2s)2 = 108s5 = 6,3 ·10–39
5_____________
Отсюда s = √ 6,3 ·10–39/ 108 = 9,0 ∙10–9 моль/л.
10.Пероксид водорода, его получение, кислотные и окислительно-восстановительные свойства (приведите примеры реакций). Пероксокислоты.
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с«металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивогокристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
 Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов и серебра:
2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4×10−12).
Химические свойства пероксида водорода. Пероксид водорода весьма реакционноспособное вещество, и может проявлять как окислительные так и восстановительные свойства. В водных растворах проявляет слабые кислотные свойства:
H2O2 + H2O <--> H3O+ + HO2—.
a) Окислительные свойства пероксида водорода. Окисление нитрита калия до нитрата:
KNO2 + H2O2 (разб. H2SO4)--> KNO3 + H2O,
выделение иода из иодида калия:
2KI + H2O2 --> I2 + 2KOH,
2KI + H2O2 + H2SO4 --> I2 + K2SO4 + 2H2O.
Окисление сульфида свинца до сульфата применяют в реставрации старых картин, потемневших из-за образования сульфида свинца черного цвета:
PbS + 4H2O2 --> PbSO4 + 4H2O.
б) Восстановительные свойства пероксида водорода. Восстановление оксида серебра:
Ag2O + H2O2 --> 2Ag + O2 + H2O,
взаимодействие с перманганатом калия в кислой среде:
2KMnO4 + 5H2O2 + 3H2SO4 --> 2MnSO4 + 5O2 + K2SO4 + 8H2O.
в) Взаимодействие с основанием приводит к образованию пероксида металла:
Ba(OH)2 + H2O2 --> BaO2 + 2H2O.
г) Реакции компелексоообразования:
H2O2 + TiSO4(OH)2 + K2SO4 (разб. KOH) --> K2[Ti(SO4)2(O22—)](желто-оранж.) + 2H2O,
H2O2 + TiSO4(OH)2 + H2O (разб. H2SO4) --> [Ti(H2O)4(O22—)]SO4 (желт.).
Получение пероксида водорода:
В промышленности:
а)Пероксид водорода получают при реакции с участием органических веществ, в частности, каталитическимокислениемизопропилового спирта:
(CH3)2СН(ОН) + O2 → CH3C(O)CH3 + H2O2
б)Электролиз серной кислоты:
2H2SO4 --> H2 + H2S2O8,
полученная пероксодисерная кислота разлагается водой:
H2S2O8 + 2H2O --> 2H2SO4 + H2O2,
а пероксид водорода отделяется от серной кислоты перегонкой.
В лаборатории перекись водорода получают взаимодействием пероксидов и супероксидов щелочных и щелочно-земельных металлов с кислотами или водой:
Na2O2 + 2H2O --> 2NaOH + H2O2,
2KO2 + 2HCl --> 2KCl + H2O2 + O2,
BaO2 + H2SO4 --> BaSO4 + H2O2.
Применение:
Для более легкого отделения перекиси водорода удобнее использовать для получения перекиси водорода соединениями металлов II-А группы, так как их гидрорксиды и большинство солей нерастворимы в воде.
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство.
ПЕРОКСОКИСЛОТЫ (надкислоты, перкислоты), кислоты, анион которых содержит пероксогруппу - О-О-. Напр.: пероксоборная НВО3, пероксофосфорная Н3РО5, пероксосерная Н2SО5 (т. н. кислота Каро), пероксодисерная Н2S2О8 (надсерная) кислоты, пероксоуксусная кислота СН3СОООН. Пероксокислоты и их соли - сильные окислители. Пероксосульфаты (персульфаты) аммония (NН4)2S2О8 и калия К2S2О8 - отбеливающие вещества, инициаторы полимеризации.Пероксокислоты важны не только как окислители, но и как промежуточные соединения для получения пероксида водорода. Пероксодисерная кислота получается при электролитическом окислении иона HSO4на холоду. Пероксосерная кислота образуется при гидролизе пероксодисерной кислоты:
H2S2O8 + H2O -> H2SO5 + H2SO4
H2SO5+H2O=H2O2+H2SO4









11. Соединения азота с водородом: аммиак, гидразин, гидроксиламин. Получение. Строение молекул. Взаимодействие их с водой, кислотами; окислительно-восстановительные свойства.
а) Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.

В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
Для осушения аммиака его пропускают через смесь извести с едким натром.
Химические свойства
● Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ → NH4+
● Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
● Взаимодействуя с кислотами даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
● Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
NaNH2 + H2O → NaOH + NH3
CaNH + 2H2O → Ca(OH)2 + NH3↑
Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
● При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
4NH3 + 3O2 → 2N2 + 6H20
4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
● Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
● С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
● С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
● При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4
Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента.
б) Гидрази́н (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62·10−29Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины. Был открыт в 1887 году Теодором Курциусом.
Структурная формула гидразина:

СВОЙСТВА:
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °С:
3N2H4 → 4NH3 + N2
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина, при катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
N2H4 → N2 + 2H2
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
N2H4 + H2O → [N2H5]+ + OH−, Kb = 3,0 ⋅ 10^ − 6
(для аммиака Kb = 1,78·10−5)
Протонирование второй неподеленной пары электронов протекает ещё труднее:
[N2H5]+ + H2O → [N2H6]2+ + OH−, Kb = 8,4 ⋅ 10^ − 16
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразония N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
N2H4 + HCl → [N2H5]Cl
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Гидразин как восстановитель:
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
4KMnO4 + 5N2H4 + 6H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения (Zn + HCl):
N2H4 + Zn + 4HCl → 2NH4Cl + ZnCl2
Получение:
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO (метод Рашига):
NH3 + NaOCl → NH2Cl + NaOH
NH2Cl + NH3 → N2H4 * HCl
реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
(NH2)2CO + NaOCl + 2NaOH → N2H4 + H2O + NaCl + Na2CO3
реакция проводится при температуре ~100 °C и атмосферном давлении.
Применяется также метод Байера:
2NH3 + H2O2 → N2H4 + 2H2
Применение:
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.Гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее.
в) Гидроксилами́н NH2OH — бесцветные кристаллы, легко растворимые в воде с образованием гидрата NH2ОН·Н2О.

Свойства:
● В водном растворе диссоциирует по основному типу, являясь слабым основанием:
NH2OH + H2O → [NH3OH]+ + OH−, Ko = 2·10−8
Может также диссоциировать и по кислотному типу с рКа = 14,02:
NH2OH + H2O → NH2O− + H3O+
В кислом водном растворе гидроксиламин устойчив, однако ионы переходных металлов катализируют его распад.
Подобно NH3, гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния, например: NH2OH + HCl → [NH3OH]Cl
● На воздухе соединение является нестабильным:
3NH2OH → N2 + NH3 + 3H2O
На воздухе легко окисляется кислородом воздуха:
4NH2OH + O2 → 6H2O + 2N2
● Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O:
2NH2OH + I2 + 2KOH → N2 + 2KI + 4H2O
● В некоторых реакциях NH2OH проявляются окислительные свойства, при этом он восстанавливается до NH3 или NH4+, например:
N H 2 O H + H 2 S → N H 3 + S + H 2 O
Получение:
В лаборатории получают разложением в вакууме солей гидроксиламина: (NH3OH)3PO4 или [Mg(NH2OH)6](ClO4)2.
Спиртовой раствор гидроксиламина можно получить действием этанола на NH3OHCl.
В промышленности соли гидроксиламина получают восстановлением NO водородом в присутствии платинового катализатора или гидрированием азотной кислоты, а также действием на азотную кислоту атомарным водородом:
HNO3 + 6[ H ] → NH2OH + 2H2O
Применение:
Важнейшей солью гидроксиламина является солянокислый NH2OH·HCl. Он применяется как восстановитель в неорганическом анализе; для количественного определения формальдегида, фурфурола, камфоры, глюкозы; в фотографии и медицине.
Применяется в органическом синтезе. Гидроксиламин, взаимодействуя с альдегидами и кетонами, образует оксимы:R—CH=NOH и R2—C=NOH
12. Электролитическая диссоциация слабых электролитов. Р
 2018-01-21
2018-01-21 1380
1380







