Формулы угольной и кремниевой кислот, их химические свойства по отношению к металлам,оксидам,основаниям, специфические свойства.
Н2СО3 — угольная кислота,
Н2SiO3 — кремниевая кислота.
Н2СО3 — существует только в растворе:
Н2С03 = Н2О + С02
Н2SiO3— твердое вещество, практически нерастворимо в воде, поэтому катионы водорода в воде практически не отщепляются. В связи с этим такое общее свойство кислот, как действие на индикаторы, Н2SiO3 не обнаруживает, она еще слабее угольной кислоты.
Н2SiO3 — непрочная кислота и при нагревании постепенно разлагается:
Н2SiO3 = Si02 + Н20.
Н2CO3 реагирует с металлами, оксидами металлов, основаниями:
а) Н2CO3 + Mg = MgCO3 + Н2
б) Н2CO3 + СаО = СаСO3 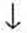 + Н20
+ Н20
в) Н2CO3 + 2NaOH = Na2CO3 + 2Н20
Карбонаты, соли угольной кислоты H2CO3.
Различают нормальные (средние) карбонаты, с анионом СО32-(например, KHCO3), кислые карбонаты (гидрокарбонаты или бикарбонаты), с анионом НСО-3 (например, КНСОз) и основные карбонаты [например, Cu2(OH)2СОз — минерал малахит]. В воде растворимы только нормальные карбонаты щелочных металлов, аммония и таллия. В результате значительного гидролизарастворы их показывают щелочную реакцию. Наиболее трудно растворимы нормальные карбонаты кальция,стронция, бария и свинца (2-валентного). Кислые карбонаты хорошо растворимы в воде.
При нагревании карбонаты, как правило, разлагаются (CaCO3 = CaO + CO2) ещё до достижения точки плавления; исключение представляют карбонаты щелочных металлов и таллия. Гидрокарбонаты при нагревании переходят в нормальные карбонаты (2NaHCO3 = Na2CO3 + H2O + CO2). Сильными кислотами нормальные и кислые карбонаты разлагаются с выделением CO2 (K2CO3 + H2SO4 = K2SO4 + H2O + CO2).
BaCO3+K2SO4=BASO4+K2CO3
BACO3+TIO2=BATIO3+CO2
BACO3+2HCL=BACL2+CO2+H2O
BACO3+C=BAO+2CO
K2CO3+2H3PO4=2K2HPO4+H2O+CO2
K2CO3=2K+CO+O2
BaCO3=BAO+CO2
K2CO3+2HCL=2KCL+CO2+H2O
K2CO3+H2O+CO2=2KHCO3
| Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ): ns2np2.Углерод и кремний углерод …2s2 2p2 кремния … 2S22P63S23p2 Со:-4,+2,+4 Оксиды 2С+О2=2СО 2СО+О2=2СО2 при восстановлении диоксида углерода раскалённым углём: СО2+С<= >2CO Кислотные свойства: СО2 восст-ые св-ва СО: 2Mg + CO2 = 2MgO + C PdCl2+CO+H2OPd+CO2+2HCl CO2 + H2O ↔ H2CO3 Ca(OH)2 + CO2 = CaCO3↓ + H2O Fe2O3+CO2Fe+3CO2 KOH + CO2 → KHCO3 SiO2+ C=CO+ SiO Гидроксид: формально C(OH)4(H4CO4) моментально отщепляет воду и превращается вH2CO3 SiO неустойчив,диспропорционирование: 2 SiO(г)= SiO2(кр)+ Si(кр) Si+O2=SiO2 Na2SiO3(HCl,-NaCl)H4SiO4(H2O)mSiO2*nH2O(осадок,гидроксид) Кислотные свойства: SiO2— кислотный оксид, не реагирующий с водой.SiO2+CaO=CaSiO3 SiO2+MgSi+MgO SiO2+4NaOH=Na4SiO4+2H2O SiO2+4HF=SiF4+2H2O SiO2+Na2CO3(сплав)Na2SiO3(жидкое стекло)+CO2 Примеры растворимых и малорастворимых карбонатов Растворимые карбонаты: K2CO3, Na2CO3, Li2CO3,(NH4)2CO3 Сa(HCO3)2(определяет времен.жесткость воды)CaCO3+CO2+H2O Малорастворимые карбонаты: BaCO3, СaCO3, СоCO3 |
44. Получение и химические свойства галогеноводородных кислот
Галогеноводороды
Соединения галогенов с водородом НХ, где X — любой галоген, называются галогеноводородами. Вследствие высокой электроотрицательности галогенов связующая электронная пара смещена в их сторону, поэтому молекулы этих соединений полярны.
Галогеноводороды — бесцветные газы, с резким запахом, легко растворимы в воде. 1При 0°С в 1 объеме воды растворяете 500 объемов НС1, 600 объемов HBr и 450 объемов HI. Фтороводород смешивается с водой в любых соотношениях. Высокая растворимость этих соединений в воде позволяет получать концентрированные растворы.
При растворении в воде галогеноводороды диссоциируют по типу кислот. HF относится к слабо диссоциированным соединениям, что объясняется особой прочностью связи в куле. Остальные же растворы галогеноводородов относятся к числу сильных кислот. HF — фтороводородная (плавиковая) кислота НС1 — хлороводородная (соляная) кислота HBr — бромоводородная кислота HI — иодоводородная кислота
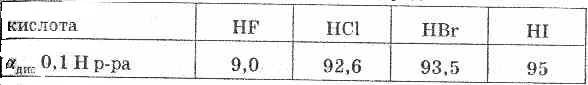
Сила кислот в ряду HF — НСl — HBr — HI возрастает, что объясняется уменьшением в том же направлении энергии связи и увеличением межъядерного расстояния. HI — самая сильная кислота из ряда галогеноводородных кислот.
Поляризуемость растет вследствие того, что вода поляризует
больше ту связь, чья длина больше. Соли галогеноводородных кислот носят соответственно следующие названия: фториды, хлориды, бромиды, иодиды.
Химические свойства галогеноводородных кислот
В сухом виде галогеноводороды не действуют на большинство металлов.
1. Водные растворы галогеноводородов обладают свойствами бескислородных кислот. Энергично взаимодействуют со многими металлами, их оксидами и гидроксидами; на металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не действуют. Взаимодействуют с некоторыми солями и газами.

Фтороводородная кислота разрушает стекло и силикаты:
SiO2+4HF=SiF4+2Н2O
Поэтому она не может храниться в стеклянной посуде.
2. В окислительно-восстановительных реакциях галогеноводородные кислоты ведут себя как восстановители, причем восстановительная активность в ряду Сl-, Br-, I- повышается.
Получение
Фтороводород получают действием концентрированной серной кислоты на плавиковый шпат:
CaF2+H2SO4=CaSO4+2HF
Хлороводород получают непосредственным взаимодействием водорода с хлором:
Н2+Сl2=2НСl
Это синтетический способ получения.
Сульфатный способ основан на реакции концентрированной
серной кислоты с NaCl.
При небольшом нагревании реакция протекает с образованием НСl и NaHSO4.
NaCl+H2SO4=NaHSO4+HCl
При более высокой температуре протекает вторая стадия реакции:
NaCl+NaHSO4=Na2SO4+HCl
Но аналогичным способом нельзя получить HBr и HI, т.к. их соединения с металлами при взаимодействии с концентрировавной серной кислотой окисляются, т.к. I- и Br- являются сильными восстановителями.
2NaBr-1+2H2S+6O4(к)=Br02+S+4O2+Na2SO4+2Н2O

Бромоводород и иодоводород получают гидролизом PBr3 и PI3: PBr3+3Н2O=3HBr+Н3PO3 PI3+3Н2О=3HI+Н3РO3
45. Гибридизация атомных орбиталей. Геометрическое строение молекул и ионов. Влия- ние неподеленной электронной пары на геометрическую конфигурацию и химические свойства молекул и ионов. (из прошлого экзамена взято)
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
 2018-01-21
2018-01-21 1288
1288
