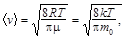Основные законы и формулы
Молекулярно-кинетическая теория идеальных газов
Количество однородного вещества (в молях)
 ,
,
где N – число молекул; N А – постоянная Авогадро; m – масса; m – молярная масса вещества.
Если система представляет собой смесь нескольких газов, то количество вещества системы
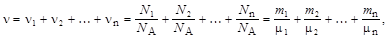
где ni, N i, m i, mi – соответственно количество вещества, число молекул, масса, молярная масса i -й компоненты смеси.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 ,
,
где р – давление; V – объем; m – масса; m – молярная масса газа; R – универсальная газовая постоянная; n – количество вещества; Т – термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения состояния для изопроцессов:
а) Закон Бойля-Мариотта (изотермический процесс – Т = const, m = const):
pV = const,
или для двух состояний газа:
р 1 V 1 = p 2 V 2;
б) закон Гей-Люссака (изобарный процесс – p = const, m = const):
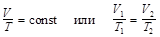 ;
;
в) закон Шарля (изохорный процесс – V =const, m = const):
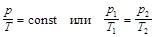 ;
;
г) объединённый газовый закон (m = const):

где р 1, V 1, Т 1 – давление, объём и температура газа в начальном состоянии; р 2, V 2, Т 2 – те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси n идеальных газов,
p = p 1 + p 2 +... + p n,
где p i – парциальное давление i -й компоненты смеси. Парциальным называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси n газов
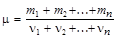 ,
,
где m i и ni – масса и количество вещества 1-го компонента смеси.
Концентрация молекул
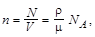
где N – число молекул в системе; V – объем системы; r – плотность вещества; N A – число Авогадро.
Формула справедлива для любого состояния вещества.
Зависимость давления газа от концентрации молекул и температуры
p = nkT,
где k – постоянная Больцмана.
Основное уравнение молекулярно-кинетической теории идеальных газов
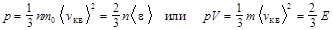 ,
,
где n – концентрация молекул; m 0 – масса одной молекулы; m – масса газа в объёме V; < v кв> – средняя квадратичная скорость молекул; <e> – средняя кинетическая энергия поступательного движения молекул; Е – суммарная кинетическая энергия поступательного движения всех молекул.
Закон Максвелла распределения молекул идеального газа по скоростям

где f (v) – функция распределения молекул по скоростям, определяющая долю числа молекул, скорости которых лежат в интервале от v до v + d v.
Число молекул, относительные скорости которых заключены в пределах от u до u + d u,

где u = v / v в – относительная скорость, равная отношению скорости молекул v к наивероятнейшей скорости v в; f (u) – функция распределения по относительным скоростям.
Распределение молекул по энергиям. Число молекул, энергии которых заключены в интервале от e до e + de,
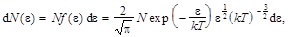
где f (e) – функция распределения по энергиям.
Скорость молекул:
наиболее вероятная –  ;
;
средняя квадратичная – 
где m 0 – масса молекулы.
Средняя кинетическая энергия поступательного движения молекулы
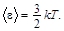
Средняя полная кинетическая энергия молекулы
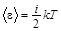 ,
,
где i – число степеней свободы молекулы.
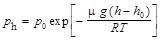 ,
,
где р h и р 0 - давление газа на высоте h и h 0.
Распределение Больцмана во внешнем потенциальном поле
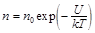 ,
,
где n – концентрация частиц; n 0 – концентрация частиц в точках, где U = 0. U – их потенциальная энергия.
Cреднее число соударений, испытываемых молекулой газа за 1 с,
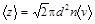 ,
,
где d – эффективный диаметр молекулы; n – концентрация молекул; á v ñ – средняя арифметическая скорость молекулы.
Средняя длина свободного пробега молекул газа
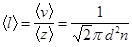 .
.
Импульс, переносимый молекулами из одного слоя газа в другой через элемент поверхности площадью D S за время d t,
 ,
,
где h – динамическая вязкость газа; d v /d z – поперечный градиент скорости течения его слоев.

где r – плотность газа (жидкости).
Закон Ньютона для силы внутреннего трения (вязкости) между слоями площадью D S
 .
.
Закон теплопроводности Фурье
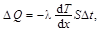
где D Q – теплота, прошедшая посредством теплопроводности через площадку S за время D t; d T /d x – градиент температуры; l – теплопроводность, для газов
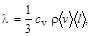
с v – удельная теплоёмкость газа при постоянном объёме; r – плотность газа; á v ñ и á l ñ – средняя арифметическая скорость и средняя длина свободного пробега молекул.
Закон диффузии Фика
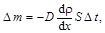
где D m – масса вещества, переносимая в результате диффузии через поверхность площадью S за время D t; d r /d х – градиент плотности; D – коэффициент диффузии; для газов
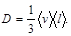
Молярная теплоёмкость газа при постоянном объёме и постоянном давлении соответственно
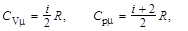
где i – число степеней свободы; R – универсальная газовая постоянная.
Связь между удельной (с) и молярной (С m) теплоёмкостями
С m = с m
где m – молярная масса.
Уравнение Майера
С рm – С Vm = R.
Внутренняя энергия идеального газа

Уравнение адиабатного процесса (уравнение Пуассона)
pV g = const, TV g-1 = const, T g p 1-g = const,
где g – показатель адиабаты,
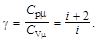
Уравнение политропы
рV n = const,
где n = (C – C p) / (C – C V) – показатель политропы.
Работа, совершаемая газом при изменении его объёма, в общем случае вычисляется по формуле
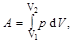
где V 1 и V 2 – начальный и конечный объемы газа.
Работа при изобарическом процессе (р = const)
A = p (V 2 – V 1),
при изотермическом (Т = const) –

при адиабатном (Q = const) –
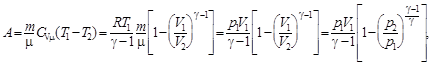
при политропном (C = const) –
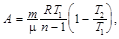
где Т 1, Т 2, V 1, V 2, p 1, p 2 – соответственно, начальные и конечные температура, объём и давление газа.
Q = D U + A,
где Q – количество теплоты, сообщённое газу; D U – изменение его внутренней энергии; А – работа, совершённая газом против внешних сил.
Первое начало термодинамики при изобарическом процессе
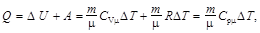
при изохорном (А = 0) –
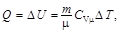
при изотермическом (D U = 0) –
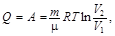
при адиабатическом (Q = 0) –

Термический коэффициент полезного действия для кругового процесса (цикла)
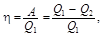
где Q 1 – количество теплоты, полученное системой; Q 2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
КПД цикла Карно
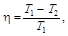
где Т 1 – температура нагревателя; Т 2 – температура холодильника.
Холодильный коэффициент машины, работающей по обратному циклу Карно,

где Q отв – количество теплоты, отведённое из холодильной камеры; А – совершённая работа; Т 2 – температура более холодного тела (холодильной камеры); Т 1 – температура более горячего тела (окружающей среды).
Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2
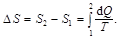
Изменение энтропии идеального газа
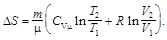
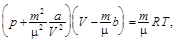
где р – давление; m – масса; m – молярная масса; a и b – постоянные Ван-дер-Ваальса; V – объем; Т – термодинамическая температура.
Связь критических параметров – объема, давления и температуры газа – с постоянными Ван-дер-Ваальса:

Внутренняя энергия реального газа
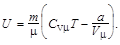
Коэффициент поверхностного натяжения
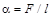 ,
,
где F – сила поверхностного натяжения, действующая на контур длиной  , ограничивающий поверхность жидкости.
, ограничивающий поверхность жидкости.
При изотермическом увеличении площади поверхности плёнки жидкости на D S совершается работа
А = a D S.
Добавочное давление D р, вызванное кривизной поверхности жидкости, выражается формулой Лапласа
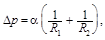
где R 1 и R 2 – радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости.
В случае сферической поверхности
D р = 2 a / R.
Высота поднятия жидкости в капиллярной трубке
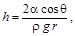
где q – краевой угол; r – плотность жидкости; g – ускорение свободного падения; r – радиус трубки.
Высота поднятия жидкости в зазоре между двумя близкими и параллельными плоскостями

где d – расстояние между плоскостями.
Уравнение Клапейрона-Клаузиуса
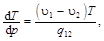
где u1 и u2 – удельные объёмы вещества в двух фазовых состояниях; Т и р – температура и давление фазового перехода; q 12 – удельная теплота фазового перехода вещества
8 Примеры решения задач по молекулярной физике
и термодинамике
Пример 1. Найти молярную массу смеси кислорода массой m 1 = 25 г и азота массой m 2 = 75 г.
Решение. Молярная масса смеси есть отношение массы смеси m см к количеству вещества смеси, т.е.
mсм = m см / nсм. (1)
Масса смеси равна сумме масс компонентов смеси:
m см = m 1 + m 2,
количество вещества смеси
nсм = n1 + n2 = m 1 / m1 + m 2 / m2.
Подставив в формулу (1) выражения для m см и nсм, получим
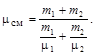
После вычислений найдем mсм = 30 × 10-3 кг/моль.
Пример 2. В баллоне вместимостью V = 10 л находится гелий под давлением р 1 = 1 МПа и при температуре Т 1 = 300 К. После того, как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т 2 = 290 К. Определить давление р 2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа,
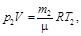
где m 2 – масса гелия в баллоне в конечном состоянии; m – молярная масса гелия; R – универсальная газовая постоянная.
Выразим искомое давление,
р 2 = m 2 RT 2 / (m V). (1)
Массу m 2 гелия выразим через массу m 1, соответствующую начальному состоянию газа, и массу гелия, взятого из баллона
m 2 = m 1 - m. (2)
Масса m 1 гелия также находится из уравнения Менделеева-Клапейрона для начального состояния гелия
m 1 = m p 1 V / (RT 1). (3)
Подставив выражения масс (2) и (3) в (1), найдём,

Проверим, даёт ли полученная формула единицу давления. Для этого в её правую часть вместо символов величин подставляем их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них даёт
единицу давления, т.к. первый сомножитель (Т 2 / Т 1) – безразмерный, а второй – давление. Проверим второе слагаемое:
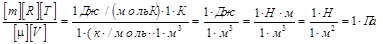
Паскаль является единицей давления. Производим вычисления, учитывая что m = 4×10-3кг/моль. Получим р 2 = 0,364 МПа.
Пример 3. Найти среднюю кинетическую энергию движения одной молекулы кислорода при температуре 350 К, а также кинетическую энергию движения всех молекул кислорода массой 4 г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия <ei> = 1 / 2 kT, где k – постоянная Больцмана, Т – термодинамическая температура газа. Поступательному движению двухатомной молекулы кислорода соответствуют три степени свободы, вращательному – две. Тогда средняя кинетическая энергия движения молекулы
<e> = 5 2 kT. (1)
Кинетическая энергия движения всех молекул газа
Е к = N <e> (2)
Число всех молекул газа
N = n N A = N А m / m. (3)
Подставив выражение N в формулу (2), получаем
Е к= 5 kTN А m /(2m) = 5 RTm /(2m). (4)
Произведём вычисления, учитывая, что для кислорода m = 32×10-3 кг/моль:
<e> = 1,21×10-20 Дж; Е к = 910 Дж.
Пример 4. Используя функцию распределения молекул идеального газа по относительным скоростям, определить число молекул, скорости которых меньше 0,002 наиболее вероятной скорости, если в объёме газа содержится N = 1,67×1024 молекул.
Решение. Число d N (u) молекул, относительные скорости которых заключены в пределах от u до u + d u,
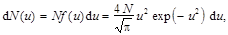
где N – число молекул в объёме газа.
По условию задач v m = 0,002 v в, следовательно u max = v max / v в = 0,002, Так как u << 1, то exp(- u 2)» 1 – u 2. Пренебрегая u 2 << 1, выражение для d N (u) можно записать в виде
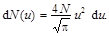
Проинтегрировав данное выражение по u в пределах от 0 до u max, найдём
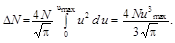
Вычисляя, получаем D N = 1016 молекул.
Пример 5. Вычислить удельные теплоёмкости при постоянном объеме и постоянном давлении неона и водорода, принимая эти газы за идеальные. Рассчитать также удельные теплоемкости смеси указанных газов, если массовые доли неона и кислорода составляют 80 и 20 % соответственно.
Решение. Удельные теплоёмкости идеальных газов определяются по формулам
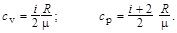
Для неона (одноатомный газ) число степеней свободы i = 3 и m1 = 20 × 10-3 кг/моль. Поэтому
с v1 = 3 × 8,31 / (2 × 20 × 10-3) = 624 Дж/(кг×К), с p1 = 1040 Дж /(кг × К).
Для водорода (двухатомный газ) i = 5 и m2 = 2×10-3 кг/моль.
c v2 = 1,04 × 104 Дж /(кг × К), с р2 = 1,46 × 104 Дж /(кг × К).
Удельную теплоёмкость смеси при постоянном объёме с v найдём следующим образом. Теплоту, необходимую для нагревания смеси на D Т, выразим двумя способами:
Q = c v (m 1 + m 2) D Т, (1)
Q = (c v,1 m 1 + c v,2 m 2)D T. (2)
Приравнивая правые части (1) и (2) и разделив обе части полученного равенства на D Т, получим
с v(m 1 + m 2) = c v,1 m 1 + c v,2 m 2.
Отсюда  или с V= c V,1w1+ c V,2w2,
или с V= c V,1w1+ c V,2w2,
где w1 = m 1 / (m 1 + m 2) и w2 = m 2 / (m 1 + m 2).
Рассуждая так же, получим формулу для вычисления удельной теплоёмкости смеси при постоянном давлении
с р = c р,1w1 + c р,2w2.
Произведём вычисления:
с v = (6,24 × 102 × 0,8 + 1,04 × 104 × 0,2) = 2580 Дж/(кг×К);
с р = (1,04 × 102 × 0,8 + 1,46 × 104 × 0,2) = 3752 Дж/(кг×К).
Пример 6. Некоторая масса кислорода при давлении р 1 = 105 Па занимает объем 10 л. Газ был нагрет сначала при постоянном давлении до объема 30 л, а затем при постоянном объеме до давления р 2 = 0,5 МПа. Найти изменение внутренней энергии газа D U 1a2, совершенную им работу А 1а2 и количество поглощенной газом теплоты Q 1а2. Произвести аналогичные расчёты в случае обратного следования процессов: сначала по изохоре, потом по изобаре (рисунок 3 кривая 1в2). Сравнить результаты расчётов в обоих случаях.
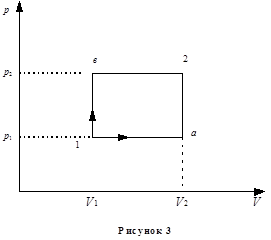
Решение. Физическую систему составляет идеальный газ – кислород. Внутренняя энергия является функцией состояния системы. Поэтому изменение внутренней энергии при переходе из одного состояния в другое
всегда равно разности значений внутренней энергии в этих состояниях и не зависит от совокупности процессов, приведших к такому переходу системы:

Здесь температуры газа в начальном и конечном состояниях были выражены из уравнения Менделеева-Клапейрона.
Работа, совершённая газом в рассматриваемом случае,
А 1а2 = А 1а + А а2.
При изобарном процессе А 1а = р 1(V 2 – V 1), при изохорном А а2 = 0. С учётом этого
А 1а2 = р 1(V 2 – V 1).
В соответствии с первым законом термодинамики
Q 1a2 = D U 1a2 + A 1a2 = i (2 V 2 – p 1 V 1) / 2 + р 1(V 2 – V 1).
Подставив числовые значения, получим
D U 1a2 = 14 × 103 Дж; A 1a2 = 2 × 103 Дж; Q 1a2 = 16 × 103 Дж.
Во втором случае переход из состояния 1 в состояние 2 идет через промежуточное состояние b. Искомые величины могут быть найдены следующим образом:
А 1b2 = р 2(V 2 – V 1);

Q 1b2 = i (p 2 V 2 – p 1 V 1) / 2 + р 2(V 2 – V 1).
Подставив численные значения, получим
D U 1b2 = 14 × 103 Дж; A1b2 = 10 × 103 Дж; Q 1b2 = 24 × 103 Дж.
Cравнивая результаты в первом и втором случаях, замечаем, что
D U 1а2 = D U 1b2; A 1b2 > A1a2; Q 1b2 > Q 1a2.
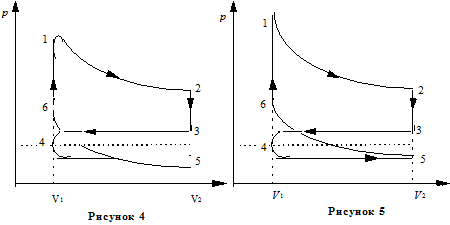
Пример 7. Найти КПД четырёхтактного двигателя внутреннего сгорания. Считать, что смесь воздуха с парами топлива и воздуха с продуктами сгорания с достаточной точностью ведёт себя как идеальный газ с показателем адиабаты g. Схема реального цикла показана на рисунке 4, а идеального – на рисунке 5.
Решение. В состоянии 1 в камере после сгорания сжатой смеси воздуха с топливом имеется газ под большим давлением р 1. Объём газа V 1.. Начинается рабочий цикл. При расширении газа по адиабате 1-2 совершается положительная работа. В состоянии 2 (нижняя мёртвая точка) расширение достигает максимума и поршень находится в крайнем положении. Объём V 2 равен сумме объёмов камеры сгорания и цилиндра. После открытия выпускного клапана давление в цилиндре падает до близкого к атмосферному. В реальном цикле выпускной клапан начинает открываться раньше достижения поршнем нижней мёртвой точки 2, поэтому переход 2-3 не строго изохорный. На участке 3-4 происходит выталкивание оставшихся в цилиндре продуктов сгорания. В верхней мёртвой точке 4 закрывается выпускной клапан и открывается впускной. На участке 4-5 происходит засасывание воздушно-топливной смеси (для карбюраторных двигателей) или воздуха (для дизельных двигателей). В точке 5 закрывается всасывающий клапан и на участке 5-6 происходит сжатие рабочей смеси. Совершается отрицательная работа. В точке 6 смесь воспламеняется, и давление в камере сжатия возрастает до р1. В идеальном цикле считаем, что точки 5 и 3 совпадают, путь 3-4 совпадает с 4-5, и никакой работы в процессе 3-4-5 не совершается.
Работа в цикле в расчёте на моль вещества
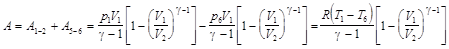 ,
,
где Т 1 и Т 6 – температуры газа в состояниях 1 и 6.
Так как g –1 = (С рm – С Vm) / С Vm = R / С Vm, то
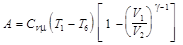 .
.
Энергия, затрачиваемая на увеличение температуры моля газа от Т 6 до Т 1,
Q = С Vm(T 1 – T 6).
КПД цикла
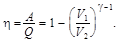
Отношение V 2 / V 1 называется степенью сжатия. Чем больше степень сжатия, тем КПД выше. Вычисляемый по полученной формуле КПД оказывается завышенным приблизительно вдвое по сравнению с действительным КПД в реальных двигателях внутреннего сгорания. Источниками расхождения являются значительные отклонения условий, принятых для идеального цикла, от условий функционирования реального цикла.
Пример 8. Идеальный газ, совершающий цикл Карно, произвёл работу
А = 600 Дж. Температура Т 1 нагревателя равна 500 К, температура холодильника Т 2 = 300 К. Определить термический КПД цикла и количество теплоты, отданное холодильнику за один цикл.
Решение. Термический КПД цикла Карно
h = (Т1 - Т2)/Т1.
Количество теплоты, отданное холодильнику,
Q 2 = Q 1 – A,
где Q 1 = A / h – количество теплоты, полученной от нагревателя. Подставляя выражение для Q 1 в формулу для Q 2, получим
Q 2 = A (1/h – 1).
Вычисляя, находим: 1) h = 0,4; 2) Q 2 = 900 Дж.
Пример 9. Определить изменение энтропии D S при изотермическом расширении азота массой 10 г, если давление газа уменьшается от 100 до 50 кПа.
Решение. Изменение энтропии, учитывая, что процесс изотермический,
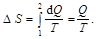 (1)
(1)
Согласно 1-му закону термодинамики, количество теплоты, полученное газом, Q = D U + A. Для изотермического процесса D U = 0, поэтому Q = A. Работа газа в изотермическом процессе
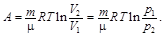
Подставив выражение для работы в формулу (1), найдём искомое изменение энтропии:
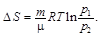
Вычисляя, получаем DS = 2,06 Дж/К.
Пример 10. Найти постоянные а и b Ван-дер-Ваальса для одного моля хлора, если известно, что критическая температура хлора Т кр = 417 К, а критическое давление р кр = 7,6 МПа. Определить внутреннюю энергию газа, если при температуре 273 К он занимает объем 2 л.
Решение. Физическую систему составляет один моль реального газа, уравнение состояния которого можно записать в виде
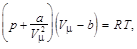
где а и b – постоянные Ван-дер-Ваальса; V m – объём одного моля.
Критические параметры определяются через постоянные а и b следующим образом:
Р кр = а / (27 b 2); Т кр = 8 а / (27 Rb); V кр = 3 b.
Выражая а и b через критическую температуру и критическое давление, находим
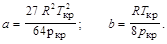
Внутренняя энергия реального газа
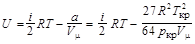 ,
,
где i = 5 – число степеней свободы; Т – температура газа.
Подставляя числовые значения, получаем: а = 0,667 Н × м4/моль;
b = 5,69×10-5 м3/моль; U = 5,34 кДж.
Пример 11. Найти добавочное давление D p внутри мыльного пузыря диаметром d = 10 см. Какую работу нужно совершить, чтобы выдуть этот пузырь?
Решение. Плёнка мыльного пузыря имеет две сферические поверхности; внешнюю и внутреннюю. Обе поверхности оказывают давление на воздух,заключённый внутри пузыря. Так как толщина плёнки очень мала, то диаметры обеих поверхностей практически одинаковы. Поэтому добавочное давление
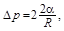
где R - радиус пузыря.
Так как R = d / 2, то D p = 8a / d.
Работа, которую нужно совершить, чтобы, растягивая плёнку, увеличить площадь её поверхности на D S, выражается формулой
A = aD S = a(S – S 0).
В данном случае S – общая площадь двух сферических поверхностей пленки мыльного пузыря, S 0 – общая площадь двух поверхностей плоской плёнки, затягивающей отверстие трубки до выдувания пузыря. Пренебрегая S 0, получаем
А = a S = 2p d 2a.
Произведя вычисления, получим
D р = 3,2 Па; А = 2,5 × 10-3 Дж.
9 Задачи к контрольной работе № 2
2.1. При нагревании идеального газа на D Т = 1 К при постоянном давлении объем его увеличился на 1/350 первоначального объема. Найти первоначальную температуру Т газа.
2.2. Баллон объемом V = 12 л содержит углекислый газ под давлением р = 1 МПа и температуре Т = 300 К. Определить массу m газа.
2.3. В цилиндр длиной l = 16 м, заполненный воздухом при нормальном атмосферном давлении р 0, начали медленно вдвигать поршень площадью S = 200 см2. Определить силу F, которая будет действовать на поршень, если его остановить на расстоянии l 1 = 10 см от дна цилиндра.
2.4. Каков может быть наименьший V объем баллона, вмещающего m = 6,4 кг кислорода, если его стенки при температуре t = 20 °С выдерживают давление р = 1,6 × 106 Па.
2.5. Два сосуда одинакового объема содержат кислород. В одном сосуде давление р 1 = 200 кПа и температура Т 1 = 800 К, в другом – р 2 = = 250 кПа, а Т 2 = 200 К. Сосуды соединили и охладили находящийся в них кислород до Т = 200 К. Определить установившееся в сосудах давление p.
2.6. В баллоне вместимостью V = 15 л находится аргон под давлением
р 1 = 600 кПа и при температуре Т 1 = 300 К. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до р 2 = 400 кПа, а температура установилась Т 2 = 260 К. Определить массу m аргона, взятого из баллона.
2.7. 10 г кислорода находятся под давлением р1 = 300 кПа при температуре t1 = 10 0 С. После расширения вследствие нагревания при постоянном давлении кислород занял объем V2 = 10 л. Найти: объем газа V 1 до расширения; температуру T2 газа после расширения; плотность r1 газа до расширения; плотность r2 газа после расширения.
2.8. Баллон объемом V = 12 л содержит углекислый газ. Давление P газа равно 1 МПа и температуре Т = 300 К. Определить массу газа в баллоне.
2.9. Вычислить плотность r азота, находящегося в баллоне под давлением
р = 2 МПа и имеющего температуру Т = 400 К.
2.10. В баллоне находится газ при температуре Т 1 = 400 К. До какой температуры Т 2 надо нагреть газ, чтобы его давление увеличилось в 1,5 раза?
2.11. Найти массу m воздуха, заполняющего аудиторию высотой h = 5 м и площадью пола S = 200 м2. Давление воздуха р = 0,1 МПа, температура помещения t = 17 °С.
2.12. Определить плотность r водяного пара, находящегося под давлением р = 2,5 кПа и имеющего температуру Т = 250 К.
2.13. В сосуде вместимостью V = 40 л находится кислород при температуре Т = 300 К. Когда часть газа израсходовали, давление в баллоне понизилось на 100 кПа. Определить массу m израсходованного кислорода. Процесс считать изотермическим.
2.14. Определить относительную молярную массу газа, если при температуре Т = 154 К и давлении р = 2,8 МПа он имеет плотность r = = 6,1 кг/ м3.
2.15. Ручной поршневой насос захватывает из атмосферы при каждом качании V 1 = 60 см3 воздуха. Сколько качаний нужно сделать насосом для того, чтобы давление р в камере велосипедной шины объемом V = = 2 дм3 повысилось на 0,15 МПа? Давление атмосферного воздуха р о = = 0,1 МПа. Нагревом воздуха в процессе сжатия пренебречь.
2.16. Открытая стеклянная колба вместимостью V = 0,4 дм3, содержащая воздух, нагрета до t 1 = 127 °С. Какой объем воды войдет в колбу при остывании ее до t 2 = 27 °С, если после нагревания ее горлышко опустили в воду.
2.17. В закрытом сосуде вместимостью V = 1 м3 находятся вода массой m 1 = = 0,9 кг и кислород массой m 2 = 1,6 кг. Найти давление р в сосуде при температуре t = 500 °С, зная, что при этой температуре вся вода превращается в пар.
2.18. Баллон вместимостью V = 5 л содержит смесь гелия и водорода при давлении р = 600 кПа. Масса m смеси равна 4 г, массовая доля гелия w1 равна 0,6. Определить температуру Т смеси.
2.19. Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением р = 1 Мпа. Считая, что масса кислорода составляет 20 % от массы смеси, определить парциальные давления р 1 и р 2 отдельных газов.
2.20. Найти плотность r газовой смеси, состоящей по массе из одной части водорода и восьми частей кислорода, при давлении р = 100 кПа и температуре Т = 300 К.
2.21. В 1 кг сухого воздуха содержится m 1 = 232 г кислорода и m 2 = 768 г азота (массами других газов пренебрегаем). Определить молярную массу воздуха.
2.22. В сосуде объемом V = 0,3 м3 содержится смесь газов: азота массой
m 1 = 2 г и кислорода массой m = 15 г при температуре Т = 280 К. Определить давление р смеси газов.
2.23. В сосуде находится смесь из m 1 = 10 г углекислого газа и m 2 = 15 г азота. Найти плотность этой смеси при температуре t = 27 °С и давлении р = 1,5 105 Н/м2.
2.24. В сосуде объемом V = 0,01 м3 содержится смесь газов: азота массой
m 1 = 7 г и водорода массой m 2 = 1 г при температуре Т = 280 К. Определить давление р смеси газов.
2.25. Какой объем занимает смесь азота массой m 1 = 1 кг и гелия массой
m 2 = 1 кг при нормальных условиях?
2.26. Углекислый газ (СО2) массой m 1 = 6 г и закись азота (N2O) массой m 2 = 5 г заполняют сосуд объемом V = 2.10–3 м3. Каково общее давление в сосуде при температуре t = 127 °С?
2.27. Считая, что в воздухе содержится w1 = 23,6 части кислорода и w2 = 76,4 части азота, найти плотность воздуха при давлении р = 90 кПа и температуре t = 13 °С. Найти парциальные давления кислорода и азота при этих условиях.
2.28. Колба вместимостью V = 0,5 л содержит газ при нормальных условиях. Определить число N молекул газа, находящихся в колбе.
2.29. Одна треть молекул азота массой m = 10 г распалась на атомы. Определить полное число N частиц, находящихся в колбе.
2.30. В сосуде вместимостью V = 2,24 л при нормальных условиях находится кислород. Определить количество вещества n и массу m кислорода, а также концентрацию n его молекул в сосуде.
2.31. Определить количество вещества n водорода, заполняющего сосуд объемом V = 3 л, если концентрация молекул газа в сосуде n = 2×108 м-3.
2.32. Определить количество вещества n и число N молекул азота массой
m = 0,2 кг.
2.33. Определить: сколько молекул N содержится в V = 1 мм3 воды; какова масса m одной молекулы воды; диаметр d молекулы воды, считая, что молекулы имеют вид шариков, соприкасающихся друг с другом.
2.34. В баллоне вместимостью V = 3 л находиться кислород массой m = 4 г. Определить количество вещества n и концентрацию n его молекул.
2.35. Сколько молекул будет находиться в V = 1 см3 сосуда при температуре t =!0 °С, если сосуд откачали до наивысшего разрежения, создаваемого современными лабораторными способами (р = 10–11 мм рт. ст.).
2.36. Определить, какую часть объема V, в котором находится газ при нормальных условиях, занимают молекулы. Диаметр d молекулы считать равным 10–10 м.
2.37. Плотность r водорода при нормальных условиях равна 0,09 кг/м3. Чему равна его молярная масса m?
2.38. Масса m 0 пылинки равна 10–8 г. Во сколько раз она больше массы молекулы m воздуха? Молярная масса m воздуха равна 29 г/моль.
2.39. Определить массу m молекулы пропана С3Н8 и его плотность r при нормальных условиях.
2.40. Плотность водорода r1 и метана r2 при нормальных условиях соответственно равны 0,09 и 0,72 кг/м3. Определить молярную m2 массу метана, если молярная масса водорода m1 = 2 10-3 кг/моль.
2.41. Какое количество N молекул содержится в m = 1 г водяного пара.
2.42. Молекула азота летит со скоростью v = 430 м/с. Найти количество движения этой молекулы.
2.43. В сосуде вместимостью V = 4 л находится водород массой m = 1 г. Какое количество N молекул находится в объеме V = 1 см3 этого сосуда?
2.44. В колбе вместимостью V = 240 см3 находится газ при температуре
Т = 290 К и давлении р = 50 кПа. Определить количество вещества n газа и число N его молекул.
2.45. Определить концентрацию n молекул кислорода, находящегося в сосуде вместимостью V = 2 л. Количество вещества n кислорода равно 0,2 моль.
2.46. Сколько N молекул газа находится в баллоне вместимостью V = 30 л при температуре Т = 300 К и давлении р = 5 МПа?
2.47. В колбе вместимостью V = 100 см3 содержится некоторый газ при температуре Т = 300 К. На сколько понизится давление р газа в колбе, если вследствие утечки газа из колбы вышло D N = 1020 молекул?
2.48. Давление р газа равно 1 мПа, концентрация n его молекул равна 1010 см-3. Определить: температуру Т газа; среднюю кинетическую энергию <eп> поступательного движения молекул газа.
2.49. Определить среднее значение <e> полной кинетической энергии одной молекулы гелия, кислорода и водяного пара при температуре Т = 400 К.
2.50. Определить кинетическую энергию <ei>, приходящуюся в среднем на одну степень свободы i молекулы азота при температуре Т = 1 К, а также среднюю кинетическую энергию <eп> поступательного движения, среднюю кинетическую энергию <eв> вращательного движения и среднее значение полной кинетической энергии <e> одной молекулы.
2.51. Чему равна энергия E теплового движения всех молекул, содержащихся в m = 20 г кислорода при температуре t = 10 °С? Какая часть этой энергии приходится на долю поступательного движения и какая – на долю вращательного движения?
2.52. Двухатомный газ массой m = 1 кг находится под давлением р = = 8.104 Па и имеет плотность r = 4 кг/ м3. Найти энергию E теплового движения всех молекул газа при этих условиях.
2.53. При какой температуре T молекулы кислорода имеют такую же среднюю квадратичную скорость < v кв>, как молекулы водорода при температуре Т 1 = 100 К?
2.54. Взвешенные в воздухе мельчайшие пылинки движутся так же, как и очень крупные молекулы. Определить среднюю квадратичную скорость < v кв> пылинки массой m = 10-10 г, если температура Т воздуха равна 300 К.
2.55. Определить среднюю квадратичную скорость < v кв> молекулы газа, заключенного в сосуд вместимостью V = 2 л под давлением р = = 200 кПа. Масса газа m = 0,3 г.
2.56. В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса каждой пылинки m = 6. 10-10 г. Газ находится при температуре Т = 400 К. Определить средние квадратичные скорости < v кв> и средние кинетические энергии <e> поступательного движения молекулы азота и пылинки.
2.57. Смесь гелия и аргона находится при температуре Т = 1,2 К. Определить среднюю квадратичную скорость < v кв> и среднюю кинетическую энергию <e> атомов гелия и аргона.
2.58. Определить наиболее вероятную скорость v в молекул водорода при температуре Т = 400 К.
2.59. Сколько степеней свободы i имеет молекула, обладающая средней кинетической энергией теплового движения <e> = 9,7 × 10-21 Дж при температуре 7 °С?
2.60. Какая часть молекул азота, находящегося при температуре Т = 400 К, имеет скорости, лежащие в интервале от v в до v в + D v, где D v = 20 м/с?
2.61. Какая часть молекул кислорода при 0 °С обладает скоростями от
v =100 м/с до v + D v = 110 м/с?
2.62. Какая часть молекул азота при температуре 150 °С обладает скоростями от v = 30 м/с до v + D v = 325 м/с?
2.63. Какая часть w молекул водорода при температуре t = 0 °С обладает скоростями от v = 2000 м/с до v + D v = 2100 м/с?
2.64. В сосуде находится кислород массой m = 8 г при температуре Т = = 1600 К. Какое число N молекул кислорода имеет энергию <eп> поступательного движения, превышающую значение 6,65×10-20 Дж,
2.65. Определить долю w молекул идеального газа, энергии которых отличаются от средней энергии <eп> поступательного движения молекул при той же температуре не более чем на 1 %.
2.66. Определить долю w молекул, энергия которых заключена в пределах от e1= 0 до e2= 0,01 k Т.
2.67. Найти относительное число w молекул идеального газа, кинетические энергии которых отличаются от наиболее вероятного значения eв энергии не более чем на 1%.
2.68. Какая часть w молекул кислорода обладает скоростями, отличающимися от наиболее вероятной v в не более чем на 10 м/с, при температуре Т = 300 К?
2.69. Определить отношение числа N 1 молекул водорода, скорости которых лежат в интервале от v 1 = 2 до v1 +D v = 2,01 км/с, к числу N 2 молекул, скорости которых лежат в интервале от v 2 = 1 до v 2 + D v =1,01 км/с, если температура водорода t = 0 °С.
2.70. Найти относительное число молекул D N / N гелия, скорости которых лежат в интервале от v = 1990 до v + D v =2010 м/с при температуре T = 500 К.
2.71. Пылинки, взвешенные в воздухе, имеют массу m = 10-18 г. Во сколько раз уменьшится их концентрация n при увеличении высоты на D h = 10 м? Температура воздуха Т = 300 К.
2.72. На сколько уменьшится атмосферное давление р = 100 кПа при подъеме наблюдателя над поверхностью Земли на высоту h = 100 м? Считать, что температура воздуха Т равна 290 К и не изменяется с высотой.
2.73. Барометр в кабине летящего вертолета показывает давление р = 90 кПа. На какой высоте h летит вертолет, если на взлетной площадке барометр показывал давление р 0 = 100 кПа? Считать, что температура Т воздуха равна 290 К и не меняется с высотой.
2.74. На какой высоте h плотность газа составляет 50% от плотности его на уровне моря. Температуру считать постоянной и равной 00 С? Задачу решить для воздуха и водорода.
2.75. Пассажирский самолет совершает полеты на высоте h = 3000 м. Чтобы не снабжать пассажиров кислородными масками, в кабинах при помощи компрессора поддерживается постоянное давление, соответствующее высоте h 2 = 2700 м. Найти разность давлений внутри и снаружи кабины. Среднюю температуру наружного воздуха считать равной Т = 273 К.
2.76. Найти в предыдущей задаче, во сколько раз плотность r1 воздуха в кабине больше плотности r2 воздуха вне ее, если температура T 1 наружного воздуха равна –20 °С, а температура T 2 внутри кабины равна +20 °С.
2.77. В атмосфере находятся частицы пыли, имеющие массу m = 8×10-22 кг. Найти, во сколько раз отличаются их концентрации на высотах h 1 = 3 м и h 2 = 30 м. Воздух находится при нормальных условиях.
2.78. На какой высоте плотность r1 газа составляет 50 % от плотности r2 его на уровне моря? Температуру Т считать постоянной и равной 273 К. Задачу решить для воздуха и водорода.
2.79. Найти изменение высоты D h, соответствующее изменению давления на D р = 100 Па, в двух случаях: 1) вблизи поверхности земли, где температура Т 1 = 290 К и давление р 1 = 100 кПа; 2) на некоторой высоте, где температура Т 2 = 220 К и давление р 2 = 25 кПа.
2.80. Барометр в кабине летящего самолета все время показывает одинаковое давление р = 80 кПа, поэтому летчик считает высоту неизменной. Однако температура воздуха изменилась на D Т = 1 К. Какую ошибку D h в определении высоты допускает летчик? Считать, что температура не зависит от высоты и что у поверхности земли давление р 0 = 100 кПа.
2.81. При подъеме вертолета на некоторую высоту h барометр, находящийся в его кабине, изменил свое показание на D p = 11 кПа. На какой высоте летит самолет, если на летной площадке барометр показывал p 0 = 0,1 МПа? Температура воздуха постоянна и равна 27 °С.
2.82. Каковы давление р и число n молекул в единице объема воздуха на высоте h = 2 км над уровнем моря. Давление на уровне моря р 0 = = 101 кПа, а температура t = 10 °С. Изменением температуры с высотой пренебречь
2.83. На какой высоте h давление p воздуха составляет 75 % от давления p 0 на уровне моря. Температуру t считать постоянной и равной 0 °С.
2.84. Сколько весит V = 1 м3 воздуха: 1) у поверхности земли; 2) на высоте
h = 4 км от поверхности земли? Давление p 0 у поверхности земли равно 105 Па. Температура с высотой не меняется и равна t = 0 °С.
2.85. Каково давление p воздуха в шахте на глубине h = 1 км, если считать что температура T по всей глубине постоянна и равна 295 К, а ускорение свободного падения g не зависит от высоты? Давление p 0 у поверхности земли равно 105 Па.
2.86. Масса m каждой из пылинок, взвешенных в воздухе, равна 10-18 г. Отношение концентрации n 1 пылинок на высоте h 1 = 0,1 м к концентрации n 2 их у поверхности земли равно 0,787. Температура воздуха Т = 300 К. Найти по этим данным число Авогадро N A.
2.87. Найти среднюю длину < l > свободного пробега молекул водорода при давлении р = 0,1 Па и температуре Т =100 К.
2.88. Баллон вместимостью V = 10 л содержит водород массой m = 1 г. Определить среднюю длину < l > свободного пробега.
2.89. Определить плотность r разреженного водорода, если средняя длина свободного пробега < l > молекул равна 1 см.
2.90. Найти среднюю продолжительность свободного пробега <t> молекул кислорода при температуре Т = 250 К и давлении р = 100 Па.
2.91. Найти среднее число < z > столкновений, испытываемых в течение t = 1 с молекулой кислорода при нормальных условиях.
2.92.Найти среднее число < z > столкновений в 1 секунду молекул углекислого газа при температуре t = 100 °С, если средняя длина свободного пробега < l > при этих условиях равна 8,7 × 10-2 см.
2.93. Во сколько раз уменьшится число столкновений < z > в 1 секунду молекул двухатомного газа, если объем V газа адиабатически увеличить в 2 раза?
2.94. Найти среднюю длину свободного пробега < l > атомов гелия в условиях, когда плотность гелия r = 2,1 × 10-2 кг/м3.
2.95. В сосуде вместимостью V = 5 л находится водород массой m = 0,5 г. Определить среднюю длину свободного пробега < l > молекул водорода в этом сосуде.
2.96. В сферической колбе вместимостью V = 3 л, содержащей азот, создан вакуум с давлением р = 80 мкПа. Температура азота T = 250 К. Можно ли считать вакуум в колбе высоким, если таким считается вакуум, в котором длина < l > свободного пробега молекул много больше линейных размеров сосуда.
2.97. В сосуде объемом V 1 = 1 дм3 находится азот при температуре t = 7 °С и давлении р = 0,2 МПа. Определить число < z > столкновений молекул азота в этом сосуде за время t = 1 секунду.
2.98. Средняя длина < l > свободного пробега атомов гелия при 00 С равна 180 нм. Определить коэффициент диффузии D гелия.
2.99. Найти массу m азота, прошедшего вследствие диффузии через площадку S = 100 см2 за t = 10 с, если градиент плотности в
направлении, перпендикулярном к площадке, равен 1,26 кг/м4. Температура азота t = 27 °С, средняя длина свободного пробега молекул азота < l > = 10-5 см.
2.100. Коэффициент диффузии D кислорода при температуре t = 0 °С равен 0,19 см2/с. Определить среднюю длину < l > свободного пробега молекул кислорода.
2.101. При каком давлении р отношение коэффициента внутреннего трения h некоторого газа к коэффициенту его диффузии D равно 0,3 г/л, а средняя квадратичная скорость < v кв> его молекул равна 632 м/с?
2.102. Найти коэффициент внутреннего трения h азота при нормальных условиях, если коэффициент диффузии D для него при этих условиях равен 8,9×10–2 м2/с.
2.103. Найти среднюю длину < l > свободного пробега молекул азота при давлении 105 Па, при условии, что его динамическая вязкость равна h = 17 мкПа×с.
2.104. Найти коэффициент диффузии D и коэффициент внутреннего трения h воздуха при давлении p = 105 Па и температуре t = 10 °С. Диаметр d молекул воздуха принять равным 3×10-10 м.
2.105. Найти коэффициент теплопроводности l водорода, если известно, что коэффициент внутреннего трения h для него при этих условиях равен 8,6 мкПа.×с
2.106. В сосуде объемом V = 2 л находится N = 4×1022 молекул двухатомного газа. Коэффициент теплопроводности газа l = 0,013 Вт/(м×К). Найти коэффициент диффузии D газа при этих условиях.
2.107. Коэффициент диффузии углекислого газа при нормальных условиях
D = 10 мм2/с. Определить коэффициент внутреннего трения h углекислого газа при этих условиях.
2.108. Найти коэффициент теплопроводности l воздуха при температуре
t =10 °С. Диаметр d молекулы воздуха принять равным 3 × 10-8 см.
2.109. Разность удельных теплоемкостей с p – с v некоторого двухатомного газа равна 260 Дж/(кг×К). Найти молярную массу m газа и его удельные теплоемкости с p и с v.
2.110. Найти удельные теплоемкости с p и с v смеси газов, содержащей кислород массой m 1 = 10 г и азот массой m 2 = 20 г.
2.111. Чему равны удельные теплоемкости c p и c v некоторого двухатомного газа, если плотность r этого газа при нормальных условиях равна 1,43 кг/м3?
2.112. Найти показатель адиабаты g для смеси газов, содержащей гелий массой m 1 = 10 г и водород – массой m 2 = 4 г.
2.113. Найти для кислорода отношение удельной теплоемкости при постоянном давлении c p к удельной теплоемкости при постоянном объеме c v.
2.114. Найти удельную теплоемкость при постоянном давлении c p следующих газов: хлористого водорода; неона; окиси азота; окиси углерода; паров ртути.
2.115. Для некоторого двухатомного газа удельная теплоемкость при постоянном давлении с p = 1,4×103Дж/(кг×К). Чему равна масса одного киломоля этого газа?
2.116. Найти показатель адиабаты g смеси водорода и неона, если массовые доли обоих газов в смеси одинаковы и равны w1 = w2 = 0,5.
2.117. Смесь газов состоит из аргона и азота, взятых при одинаковых условиях и одинаковых объемах. Определить показатель адиабаты g этой смеси.
2.118. Вычислить удельные теплоемкости при постоянном давлении с p и постоянном объеме с v неона и водорода, принимая эти газы за идеальные.
2.119. Вычислить удельные теплоемкости при постоянном объеме с v и при постоянном давлении с p смеси неона и водорода, если массовые доли неона и водорода составляют соответственно w1 = 80 и w2 = 20 %.
2.120. Газовая смесь состоит из азота массой m 1 = 3 кг и водяного пара массой m 2 = 1 кг. Принимая эти газы за идеальные, определить удельные теплоемкости с p и с v газовой смеси.
2.121 Трехатомный газ под давлением р = 240 кПа и температуре t = 20 °С занимает объем V = 10 л. Определить молярную теплоемкость газа С p при постоянном давлении.
2.122. Вычислить удельные теплоемкости газа c p и c v, зная, что его молярная масса m = 4×10-3 кг/моль и отношение мольных теплоемкостей С p / С v = 1,67.
2.123. Одноатомный газ при нормальных условиях занимает объем V = 5 л. Вычислить теплоемкость С v этого газа при постоянном объеме.
1.124. Отношение удельных теплоемкостей с р и с v смеси нескольких киломолей азота и n2 = 5 киломолей аммиака равно 1,35. Определить число n1 киломолей азота в смеси.
1.125. Азот массой m = 5 кг, нагретый на Т = 150 К, сохранил неизменным объем V. Найти количество теплоты Q, сообщенное газу; изменение внутренней энергии D U и совершенную газом работу А.
1.126. Азот нагревался при постоянном давлении, причем ему было сообщено количество теплоты Q = 21 кДж. Определить работу А, которую совершил при этом газ, и изменение D U его внутренней энергии.
1.127. Объем V водорода при изотермическом расширении при температуре Т = 300 К увеличился в 3 раза. Определить работу А, совершенную
газом, и теплоту Q, полученную газом при этом процессе. Масса m водорода равна 200 г.
1.128. При адиабатическом сжатии кислорода массой m = 1 кг совершена работа А = 100 кДж. Определить конечную температуру Т 2 газа. если до сжатия кислород находился при температуре T 1 = 300 К.
2.129. На нагревание кислорода массой m = 160 г на Т = 12 К было затрачено количество теплоты Q = 1,76 кДж. Как протекал процесс: при постоянном объеме или постоянном давлении?
2.130. При изотермическом расширении кислорода, содержащего количество вещества n = 1 моль и имевшего температуру Т = 300 К, газу было передано количество теплоты Q = 2 кДж. Во сколько раз увеличился объем газа?
2.131. При адиабатическом сжатии кислорода массой m = 20 г его внутренняя энергия увеличилась на D U = 8 кДж. Температура при этом повысилась до Т 2 = 900 К. Найти повышение температуры D Т и конечное давление газ
 2017-11-01
2017-11-01 3125
3125