
ВЗМО молекулы CO является s-молекулярная орбиталь

Схема энергетических уровней s и p орбиталей монооксида углерода

НВМО молекулы CO является π*
(разрыхляющая) молекулярная орбиталь

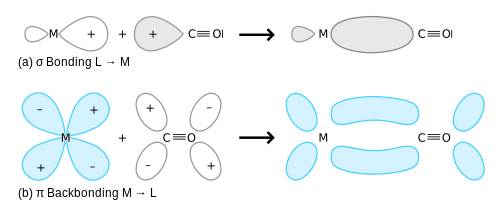
Монооксид углерода связывается с атомами переходных металлов по механизму обратного донирования. Связывание состоит из трех компонентов, что приводит к образованию частично тройной связи. Сигма-связь возникает при перекрывании несвязывающей sp-гибридизированной орбитали (с парой электронов) на атоме углерода с d-, s- и р-орбиталями атома металла. Две p-связи образуются при перекрывании заполненных d-орбиталей атома металла с двумя p-разрыхляющими орбиталями атома углерода в молекуле СО. Последний вид связывания требует наличия у атома металла d-электронов и его относительно низкой степени окисления (<+2), в противном случае обратное донирование не является выгодным. Как только электроны металла заполняют p*-разрыхляющие орбитали СО, они ослабляют связь углерод−кислород по сравнению со свободной молекулой монооксида углерода, в то время как связь металл−углерод усиливается. Множественный характер связи М−СО приводит к укорочению расстояния металл−углерод, которое часто меньше 1,8 Å, что примерно на 0,2 Å короче, чем связь металл−алкил. Описать приблизительный механизм связывания молекулы CO с атомом металла можно с использованием резонансных структур канонических форм молекул.
 2017-11-01
2017-11-01 1082
1082








