При подготовке к ответу на задания типа «Как осуществить следующие превращения: А→В→С→Е→Х» или «Составьте уравнения реакций в ряду превращений: А→В→С→Е→Х» можно предложить следующий порядок действий:
1. Укажите последовательность предлагаемых превращений, пронумеровав каждую стрелку в цепочке превращений. Помните, что в таких заданиях противоположные стрелки между двумя формулами означают не знак обратимости, а необходимость получения каждого из соединений по необратимой реакции, поэтому как над верхней, так и под нижней стрелками в уравнении реакции поставьте номер: А1→В2→С3↔4Е.
2. В соответствии с составленной нумерацией процессов приведите уравнения химических реакций, укажите условия их протекания, название веществ, расставьте коэффициенты, укажите к какому типу относится каждая реакция. Помните, что переход от одного вещества к другому не всегда может быть осуществлен в одну стадию, поэтому поставленному вами одному номеру могут отвечать одно, два или более уравнений реакций последовательно протекающих процессов. Например: Cu→Cu(OH)2. 1. 2Cu+O2→2CuO.
2. CuO+2HCl→CuCl2+H2O. 3. CuCl2+2KOH→Cu(OH)2+2KCl.
3. Уравнения реакций, протекающих в водных растворах электролитов или с их участием, составьте не только в молекулярном виде, но также в полной и краткой ионно-молекулярной форме. Краткие ионно-молекулярные уравнения могут объяснить направленность реакций.
При выполнении пп. 3 не забудьте воспользоваться справочными материалами: таблицей растворимости в воде солей, кислот и оснований; таблицей сильных и слабых электролитов; электрохимическим рядом напряжений металлов (смотрите приложения А, Б, В).
Помните о правиле направленности реакций в растворах электролитов – реакции протекают в направлении образования труднорастворимого вещества, газообразного вещества или слабого электролита, и правиле составления ионно-молекулярных уравнений.
Пример решения: составьте уравнения реакций протекающих в следующей цепочке превращений:





 Mg 1↔2 MgCI2 3 → Mg(OH)2 5→ MgSO4 6→ MgCO3 9
Mg 1↔2 MgCI2 3 → Mg(OH)2 5→ MgSO4 6→ MgCO3 9
14 13 11 4 8 7 10
Mg(OH)Cl 12 MgO Mg(HCO3)2
Решение: 1. Mg → MgCI2
хлорид магния
Магний – активный металл (смотрите приложение В). Он легко взаимодейтсвует с простыми и сложными веществами. Поэтому данный переход может быть осуществлен различными путями:
а) взаимодействие магния с хлором – сгорание магния в хлоре:
Mg + CI2 → MgCI2 – реакция соединения, окислительно –восстановительная, экзотермическая:
Мg0 - 2ē → Mg2+ - процесс окисления,
восстановитель
CI20 + 2ē → 2CI− - процесс восстановления;
окислитель
б) взаимодействием магния с разбавленным раствором хлорводородной кислоты:
Mg + 2HCI → MgCI2 + H2 – реакция замещения, окислительно-восстановительная:
Mg0 - 2ē → Mg2+ - процесс окисления,
восстановитель
2H+ + 2ē → H20 – процесс восстановления;
окислитель
в) взаимодействием магния с раствором соли менее активного металла, например, с хлоридом меди (II):
Mg0 + CuCI2 → MgCI2 + Cu0 – реакция замещения, окислительно-восстановительная:
Mg0 - 2ē → Mg2+ - процесс окисления,
восстановитель
Cu2+ + 2ē → Cu0 – процесс восстановления.
окислитель
2. MgCI2 → Mg
магний
Магний – активный металл, стоящий в ряду напряжений до алюминия. Такие металлы получают путем электролиза расплава солей:
MgCI2 → Mg + CI2 – реакция разложения,
окислительно-восстановительная, электролиз расплава соли.
При расплавлении соль диссоциирует на ионы – подвергается термической диссоциации:
MgCI2 → Mg2+ + 2CI-.
расплав
При пропускании постоянного электрического тока через расплав соли MgCl2 катионы магния подходят к отрицательно заряженному электроду – катоду, а ионы хлора – к положительно заряженному электроду – аноду. На катоде происходит процесс восстановления катионов магния, а на аноде – процесс окисления ионов хлора:
Катод (-): Mg2+ + 2ē → Mg0 –процесс восстановления, первичный процесс,
окислитель
Анод (+): 2CI- - 2ē → 2CI0 - процесс окисления, первичный процесс,
CI0 + CI0 → CI2 – вторичный процесс.
восстановитель
Общее уравнение процесса: MgCI2 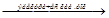 Mg + CI2.
Mg + CI2.
3. MgCI2 → Mg(OH)2.
гидроксид магния
Гидроксид магния – труднорастворимое основание (смотрите приложение А), может быть получено при взаимодействии соли магния с раствором щелочи:
MgCI2 + 2KOH → Mg(OH)2 + 2KCI – реакция обмена.
Полное ионное уравнение:
Mg2+ + 2CI- + 2K+ + 2OH- → Mg(OH)2 + 2K+ + 2CI-.
Краткое ионное уравнение:
Mg2+ + 2OH- → Mg(OH)2.
ВНИМАНИЕ! Студенты часто допускают ошибки, составляя уравнения реакций получения труднорастворимых оснований из солей, предлагая реакций гидролиза солей:
MgCI2 +2 HOH ↔ 2Mg(OH)2 + 2HCI.
СЛЕДУЕТ ПОМНИТЬ, что процесс гидролиза хлорида магния, как и других подобных солей, образованных труднорастворимым многокислотным основанием и сильной кислотой,- многоступенчатый процесс. При обычных условиях такие соли подвергаются гидролизу по первой ступени гидролиза, с образованием основной соли, а не труднорастворимого гидроксида:
MgCI2 + HOH ↔ MgOHCI + HCI. Обратите внимание – процесс обратим!
4. Mg(OH)2 → MgO
оксид магния
Труднорастворимые основания подвергаются термическому разложению на оксид металла и воду:
Mg(OH)2 → MgO + H2O – реакция разложения, эндотермическая.
5. Mg(OH)2 → MgSO4
сульфат магния
Важнейшее свойство всех оснований, как растворимых, так и трудно- растворимых в воде, - их взаимодействие с растворами кислот (реакция нейтрализации):
Mg(OH)2 + H2SO4 → MgSO4 +2H2O – реакция обмена, нейтрализации.
Mg(OH)2 + 2H+ + SO42- → Mg2+ + SO42- + 2H2O;
Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
6. MgSO4 → MgCO3.
карбонат магния
Получение соли из соли возможно при взаимодействии: а) соли с кислотой, б) соли с другой солью, если одна из образовавшихся солей является труднорастворимой. Первый способ «соль + кислота» использовать невозможно, так как угольная кислота слабее серной и не может вытеснить ее из соли. Во втором способе «соль + соль» продуктом реакции является карбонат магния – труднорастворимая соль, поэтому возможна реакция обмена при взаимодействии двух растворимых солей друг с другом:
MgSO4 + K2CO3 → MgCO3↓+ K2SO4 – реакция обмена.
Mg2+ + SO42- + 2K+ + CO32- → MgCO3 + 2K+ + SO42-;
Mg2+ + CO32- → MgCO3.
7. MgCO3 → MgO.
оксид магния
Карбонаты большинства металлов (кроме карбонатов щелочных металлов) термически не устойчивы и разлагаются при высокой температуре на оксид металла и оксид углерода (IV):
MgCO3 → MgO + CO2 – реакция разложения, эндотермическая.
8. MgO → MgSO4.
сульфат магния
Соль из основного оксида можно получить различными путями:
а) взаимодействием основного оксида с кислотным оксидом:
MgO + SO3 → MgSO4 – реакция соединения, экзотермическая:
б) взаимодействием основного оксида с кислотой:
MgO + H2SO4 → MgSO4 + H2O – реакция обмена.
MgO + 2H+ + SO42- → Mg2+ + SO42- + H2O,
MgO + 2H+ → Mg2+ + H2O.
9. MgCO3 → Mg(HCO3)2
гидрокарбонат магния
Превращение нормальной (средней) соли в кислую происходит при избытке кислоты (или кислотного оксида, пропускаемого через систему, содержащую труднорастворимую соль):
MgCO3 + H2O + CO2 → Mg(HCO3)2 – реакция соединения.
MgCO3 + H2O + CO2 → Mg2+ + 2HCO3ˉ.
Нужно обратить внимание на ионное уравнение реакции: продукт реакции – кислая хорошо растворимая в воде соль, сильный электролит, поэтому формулу кислой соли необходимо записать в ионном виде. Такая реакция ионного обмена протекает необратимо, так как ион HCO3-, слабый электролит (смотрите приложение Б).
10. Mg(HCO3)2 → MgCO3.
карбонат магния
Это реакция обратная предыдущей. Средние соли из кислых солей могут быть получены двумя путями: «кислая соль + растворимое основание», термическое разложение кислой соли. В нашем случае первый процесс неосуществим, так как гидроксид магния труднорастворим. Возможен второй процесс – незначительное нагревание, в случае раствора соли – кипячение раствора:
Mg(HCO3)2 → MgCO3 + H2O + CO2 – реакция разложения, эндотермическая.
Mg2+ + 2HCO3- → MgCO3 + H2O + CO2.
11. Mg(OH)2 → Mg(OH)Cl
гидроксохлорид магния
Основные соли могут быть образованны путем постепенного обмена гидроксид анионов ОН- в многокислотном основании на анионы кислотного остатка.
Mg(OH)2 + HCl → Mg(OH)Cl + H2O – реакция обмена,
Mg(OH)2 + H+ + Cl− → Mg(OH)Cl + H2O.
12. Mg(OH)Cl → Mg(OH)2
гидроксид магния
Основные соли могут взаимодействовать как со щелочами (п. 12), так и с кислотами (п. 13).
Mg(OH)Cl + KOH → Mg(OH)2 + KCl – реакция обмена,
Mg(OH)Cl + K+ + OH− → Mg(OH)2 + K+ + Cl−,
Mg(OH)Cl + OH− → Mg(OH)2 + Cl−.
13. Mg(OH)Cl → MgCl2
хлорид магния
Mg(OH)Cl + HCl → MgCl2 + H2O – реакция обмена,
Mg(OH)Cl + H+ + Cl− → Mg2+ + 2Cl− + H2O,
Mg(OH)Cl + H+ → Mg2+ + Cl− + H2O.
14. MgCl2 → Mg(OH)Cl
гидроксохлорид магния
Основные соли могут быть получены путем постепенного обмена анионов соли, образованной слабым многокислотным оснований (амфотерным гидроксидом) и кислотой, на гидроксид – анионы, путем взаимодействия избытка раствора соли с недостатком раствора щелочи.
MgCl2 + KOH → Mg(OH)Cl + KCl – реакция обмена,
Mg2+ + 2Cl− + K+ + OH− → Mg(OH)Cl + K+ + Cl−,
Mg2+ + Cl− + OH− → Mg(OH)Cl.
 2017-11-01
2017-11-01 4479
4479
